上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
His标签蛋白纯化那些事儿,你知道吗?
1683 人阅读发布时间:2020-12-17 09:43
His作为重组蛋白构建最常用的标签,
相信奋战在实验室的小伙伴们并不陌生,
可是看似简单的纯化,想要做好并不容易,
废了九牛二虎之力终于把蛋白构建成功,做纯化时没有目的条带,
此时的你是不是蓝瘦、香菇

其实,要想得到理想的蛋白纯化效果,很多实验过程中的细节问题是需要我们注意的,那我们就来看一下His标签纯化的一些常见问题吧!

 01 His标签纯化推荐的缓冲液条件?
01 His标签纯化推荐的缓冲液条件?
Binding buffer:20 mM sodium phosphate, 0.5 M NaCl, 20–40 mM imidazole, pH 7.4
Elution buffer:20 mM sodium phosphate, 0.5 M NaCl, 500 mM imidazole, pH 7.4
His标签在中性或碱性条件(pH7~8)下,与Ni2+有更强的结合力,与Tris-HCl缓冲液相比,在磷酸缓冲液中His标签表现出与Ni2+更强的结合力。
 02 镍柱的蛋白结合载量?
02 镍柱的蛋白结合载量?
HisTrap HP和HisTrap FF的蛋白结合载量都是至少40mg (His) 6重组蛋白。大家可以根据填料的结合载量选择预装柱和填料的规格。
 03 蛋白纯化后怎样去除多余的咪唑?
03 蛋白纯化后怎样去除多余的咪唑?
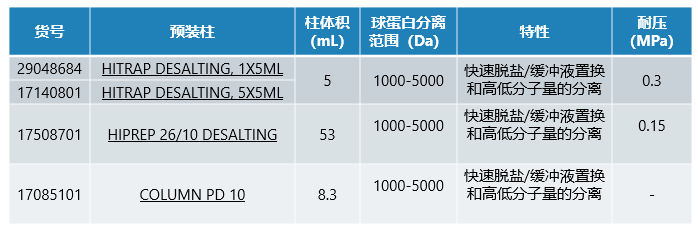
如果目标蛋白中的咪唑需要去除,可以根据样品体积选择适合的上机脱盐柱(HiTrap Desalting)或者手动脱盐柱。
 04 HisTrap柱子如何储存?
04 HisTrap柱子如何储存?
HisTrap预装柱或者填好的柱子储存在20%乙醇中、4℃-30℃条件下。
 05 如何进行脱镍和挂镍?
05 如何进行脱镍和挂镍?
Cytiva的柱子都是可以正常重复使用的。正常用缓冲液冲洗后就可以进行再次使用。
如果柱子堵了,变色,不能正常使用等,此时需要进行脱镍和挂镍操作。
Stripping:
Recommended stripping buffer: 20 mM sodium phosphate, 0.5 M NaCl, 50 mM EDTA, pH 7.4。
1、用5-10倍柱体积的stripping buffer洗柱子;
2、用5-10倍柱体积的binding buffer洗柱子;
3、用5-10倍柱体积的蒸馏水洗柱子。
Recharging:
1、HisTrap 1ml和5ml的预装柱使用0.5ml或者2.5ml终浓度为0.1M 的NiSO4(溶于蒸馏水中)装柱子;
2、用5倍柱体积的蒸馏水洗柱子;
3、用5倍柱体积的binding buffer洗柱子。
 06 裂解液的粘性较高怎么办?
06 裂解液的粘性较高怎么办?
如果裂解液因为宿主核酸浓度高而粘性较高,可以连续超声直到粘性降低,或者加入5 μg/ml的DNase I,1 mM的Mg离子,在冰上孵育10到15 min。
 07 目的蛋白不挂柱?
07 目的蛋白不挂柱?
目的蛋白不挂柱主要是因为蛋白和柱子结合能力不足导致的,我们可以从以下几点排查问题。
1、His标签没有充分暴露:在蛋白中加入适量的尿素或盐酸胍等变性剂看下蛋白能不能挂柱,若可以挂柱可以尝试在变性条件下纯化,如果不能接受蛋白变性纯化,那可以在上游分子水平改变His的长度或位置,让His暴露在蛋白表面。
2、His标签是否还在?大肠杆菌外源蛋白表达过程中,有时候会出现序列丢失的现象,如果标签丢失,蛋白自然就无法挂柱了,检测His标签,可直接用His抗体通过用Western-Blot方法检测。
3、缓冲液条件是否合适:如果缓冲液中有EDTA、柠檬酸等金属离子螯合剂,必须要去掉;此外适当提高缓冲液pH、降低咪唑浓度、调整缓冲液中盐离子浓度或者更换缓冲液都可能会提高His标签蛋白的挂柱能力。
4、纯化时蛋白和柱子接触时间过短:可以适当延长蛋白和柱子的接触时间。
5、当流穿液和洗脱液中都有目的蛋白时,可能是由于样品的蛋白超过柱子的载量,这时可以用几个HisTrap柱串联使用;或者更换体积大的柱子。
 08 蛋白挂柱后洗脱不下来?
08 蛋白挂柱后洗脱不下来?
蛋白挂柱后洗脱不下来主要是因为蛋白和柱子结合能力太强或者洗脱条件太温和,我们可以从以下几方面考虑解决问题。
1、洗脱条件太温和:重新摸索洗脱条件,增加缓冲液中咪唑浓度或者适当降低缓冲液pH以确定最佳的洗脱条件或者更、换缓冲液的成分(换成tris-HCl缓冲液)。
2、蛋白在柱子中沉淀:适当降低上样量或蛋白浓度,用咪唑线性洗脱。使用添加剂或者改变NaCl的浓度,或者在变性的条件下洗脱(加4-8M的尿素或者4-6M的盐酸胍)。
3、非特异性的疏水或者其他作用:在洗脱液中加非离子的添加剂(例如0.2%的Triton X-100)或者增加NaCl的浓度。
4、蛋白和柱子接触时间过长:可以减少蛋白和柱子的接触时间。
 09 洗脱的蛋白不纯
09 洗脱的蛋白不纯
1、目的蛋白被蛋白酶部分降解:添加适量蛋白酶抑制剂。
2、污染物对镍离子有高度亲和性:用一个梯度的或者线性的咪唑浓度进行洗脱,确定一个适合的咪唑浓度。在样品中加入和binding buffer中同样的咪唑浓度。如果还是不能去除污染物,尝试使用离子交换层析或者分子筛进行进一步纯化。
3、污染物和目的蛋白有相互作用:在洗脱液中增加添加剂的浓度(如增加到2% Triton X-100或者2% Tween 20),或者增加甘油(增加至50%)来破坏非特异性结合。
4、双标签纯化:StrepII也是一个长度较小的标签,如果纯化出的蛋白不纯,可以尝试在蛋白氨基酸两端分别加His和StrepII标签,进行两步亲和纯化。
5、优化金属离子:纯度不够主要是是因为宿主蛋白中一些含有His标签的天然蛋白也结合在了柱子上,那可以尝试更换成结合能力较弱的Co2+,使得杂质蛋白无法结合,进而提高蛋白的纯度。

看了这么多His标签的常见问题,大家是不是已经跃跃欲试啦!



































