上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析 | 凋亡细胞内蛋白酶触发DNA组装评估肿瘤治疗疗效
95 人阅读发布时间:2025-02-10 17:11
大家好!今天我要介绍的是一篇2023年刊登于《美国化学会志》(JACS)的论文,标题为“Protease-Triggered, Spatially Controlled DNA Assembly in Apoptotic Cells for Early Evaluation of Therapeutic Efficacy”。该研究提出了一种创新的模块化策略,利用凋亡细胞内的蛋白酶作为开关,触发DNA的精准自组装过程,进而实现对肿瘤治疗早期效果的评估。论文的通讯作者李乐乐教授,来自中国科学院国家纳米科学与技术中心,其研究团队深耕于细胞及生物体内的精准化学测量、光控检测技术及化学生物学调控领域。

背景概述
自然界中,DNA作为构建单元已被科研人员巧妙地组装成多种功能强大的复杂结构,广泛应用于生物传感、成像、分子计算及药物递送等领域。然而,实现活细胞内DNA的可控自组装仍是一大挑战,因为现有技术大多局限于非生命环境,且活细胞内能触发DNA自组装的天然分子资源有限。鉴于蛋白酶在生理和病理过程中的关键作用,特别是其活性变化与肿瘤进展的紧密联系,研究团队致力于开发一种基于蛋白酶驱动的活细胞内DNA自组装技术。
设计理念
研究团队设计了一种基于蛋白酶(特别是Caspase-3,一种关键凋亡蛋白酶)触发的DNA自组装方法。他们选用了杂交链式反应(HCR)作为DNA组装的模型,并巧妙引入肽核酸(PNA)作为DNA与肽段的连接桥梁。具体而言,他们设计了一种DNA发夹结构(H1),其3'端通过PNA连接至一个包含Caspase-3可裂解肽段的PNA-肽底物-PNA三嵌段共聚物(PSP)。在凋亡细胞内,Caspase-3会裂解肽段,解除对HCR的抑制,从而触发DNA的自组装过程。这一设计不仅实现了对凋亡细胞内Caspase-3活性的精准检测,还展示了其作为早期评估肿瘤治疗疗效的潜力。
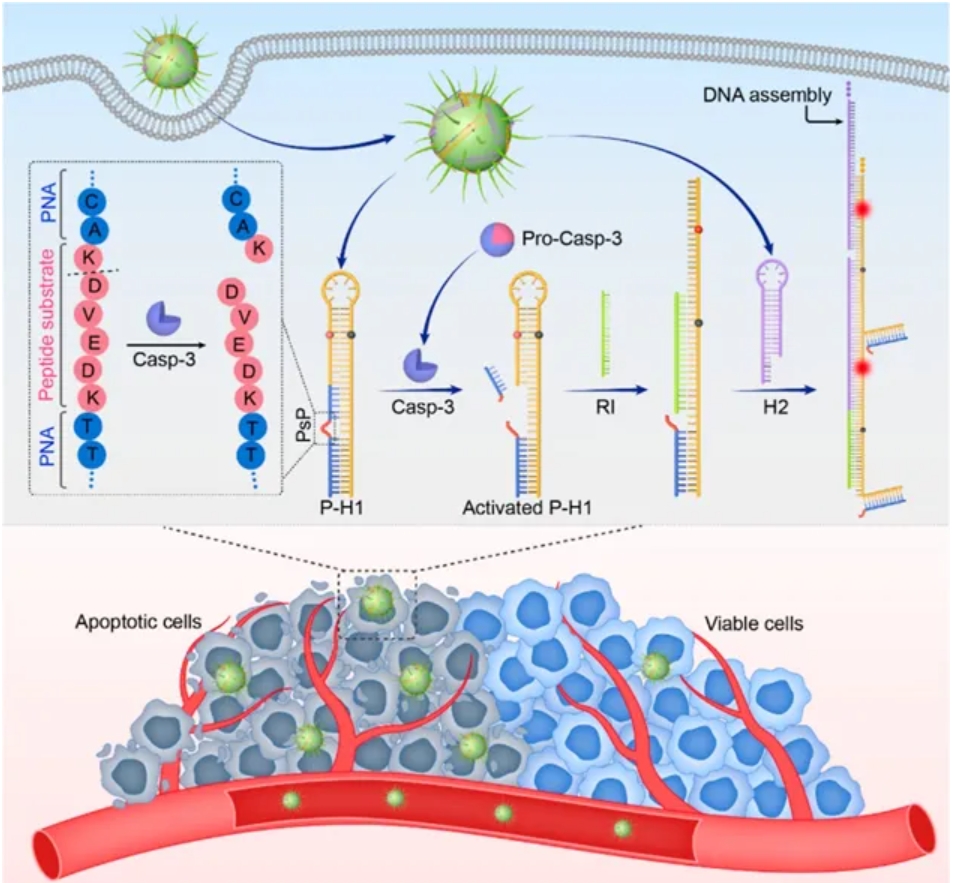
凋亡细胞中Casp-3触发DNA自组装机制的示意图
实验验证
实验首先在试管中验证了Caspase-3触发的DNA自组装机制,随后在凋亡的HeLa细胞中成功实现了这一过程。利用超支化聚β氨基酯(HPBAE)作为载体,研究团队将DNA组装单元有效递送至细胞内,并通过荧光信号的变化监测了Caspase-3的活性。进一步地,他们评估了不同药物剂量对肿瘤细胞凋亡及Caspase-3活性的影响,结果表明该体系能够准确反映肿瘤细胞的凋亡状态及药物疗效。
体内研究
在动物模型中,研究团队通过瘤内注射药物和DNA组装探针,观察了体内环境下Caspase-3触发的DNA自组装过程。全身荧光成像结果显示,该体系能够有效区分经药物治疗后凋亡的肿瘤细胞与未治疗的细胞,且荧光信号强度与Caspase-3活性呈正相关。此外,通过比较不同剂量药物处理后的荧光信号,研究团队还验证了该体系在评估化疗疗效方面的应用价值。
总结与展望
综上所述,本研究成功开发了一种基于蛋白酶触发的DNA自组装策略,实现了对凋亡细胞内Caspase-3活性的精准检测及肿瘤治疗早期疗效的评估。这一创新方法不仅丰富了DNA纳米技术的发展,还为肿瘤治疗的个性化评估和药物筛选提供了新的思路。未来,随着研究的深入,该技术有望在肿瘤诊断、治疗监测及药物研发等领域发挥更加重要的作用。
| 名称 | 货号 | 规格 |
| FITC Annexin V Apoptosis Detection Kit II | 556570 | 100tests |
| Annexin V-PE Early Apoptosis Detection Kit | 40295S | 1Kit |



































