上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
代理

斯达特
抗体/ELISA 试剂盒/试剂
已认证品牌介绍
杭州斯达特是一家集研发、生产、销售与技术服务为一体的高科技生物公司,志在为全球生物医学研究、体外诊断企业、生物制药企业提供优质的抗体、蛋白、试剂盒和定制服务,包括科研抗体、CDx 和 IVD 抗原和抗体原料、一步法 ELISA 试剂盒、鼠兔通用二抗试剂盒以及其他用途的免疫试剂整体解决方案。公司核心团队深耕抗体研发十五年,具有成功开发数千种精准医学抗体、科研抗体的丰富经验。公司建立了多物种单 B 细胞抗体开发平台(兔单抗,鼠类单抗等)、传统鼠单抗、重组蛋白表达平台及完善的抗体应用验证和检测体系(包括免疫层析,酶联免疫,流式分析,免疫组化,免疫印迹,免疫荧光,免疫沉淀等)。已正式通过欧盟 98/79/EC 认证、ISO9001 认证和 ISO13485 认证。公司以加速人类、疾病诊断、为人类和动物健康保驾护航为使命,以扎实的科学技术为基础,秉承向正向善向上的价值观,以行业客户需求为导向,愿与全球同仁精诚合作,共启健康新篇章。斯达特,专注于抗体研发和制造,您的最佳抗体优选伙伴。
代理

Absin
生物化学/抗体
已认证品牌介绍
爱必信(上海)生物科技有限公司 Absin Bioscience Inc. 成立于 2010 年,公司位于浦东新区张江医谷园区,公司以研发、生产和销售自主品牌(Absin® )产品。 我们的目标是为生命科学等相关领域的客户提供全面的的生物化学试剂,目前主要产品:生物化学试剂 60 万种,抗体 10 万种,以及各种特色优质的高性价比产品,我们的产品还在不断丰富和完善中。
代理

LabEx
技术服务
已认证品牌介绍
上海乐备实生物技术有限公司,建立了多种免疫学分析领域的多因子及多组学平台。 已拥有空间多组学、单细胞测序、PCR Array、液相微阵列Luminex、MSD电化学发光、Elispot、蛋白芯片、抗体芯片、CBA多色流式检测、多色免疫组化等超20个多因子及多组学技术平台,为广大科学研究者提供从核酸到蛋白,从细胞到组织,再到空间的多维度检测服务。
代理

Cytiva
实验室仪器 / 设备/试剂/耗材/细胞库 / 细胞培养
已认证品牌介绍
Cytiva(思拓凡)的前身是 GE 医疗生命科学事业部,现在隶属于丹纳赫集团旗下的生命科学平台。作为全球生命科学领域的领先者,Cytiva(思拓凡)致力于促进与加速全球医疗的发展。Cytiva(思拓凡)年销售额超过 33 亿美元,,并在全球 40 多个国家拥有近 7000 名员工。作为值得信赖的合作伙伴,Cytiva(思拓凡)全面助力客户提升研究与生产流程中的速度、效率与能力,赋能创新型药物的发展和生产,惠及全球患者。
代理

Novus
抗体/试剂
已认证品牌介绍
美国Novus Biologicals公司是一家抗体专业公司,生产用于研究的单克隆和多克隆抗体。Novus是一家位于美国科罗拉多州的专业抗体生产公司,曾为多家有影响的抗体品牌提供OEM加工服务。Nocus产品以抗体为主,包含5万多种一抗和近1000种二抗,产品涉及神经生物学,细胞凋亡,肿瘤,DNA修复,干细胞标记,信号转导等多个研究方向。多年的抗体生产服务经验,使novus得以引领生物科学发展趋势,并可随时为生物科研工作者提供最新和最广泛的产品。 凋亡研究相关的重组蛋白、抗体、凋亡诱导因子等,自噬研究相关抗体;包含血管生成、乳腺癌、胞外基质、黑色素瘤细胞标记、有丝分裂调节剂、卵巢癌细胞标记、前列腺癌、肾细胞癌细胞标记、肿瘤抑制等研究方向的产品;碱基切除修复、检验点信号、染色质研究、直接逆转DNA损伤、DNA双链断裂修复、DNA聚合酶、DNA复制,转录,翻译和剪接、编辑和处理内切酶、敏感基因的DNA损伤剂、同源重组、错配修复、调制DNA池、非同源末端连接、核苷酸切除修复、锌指等。2013年10月30日,NOVUS Biologicals宣布收购了Imgenex公司,收购Imgenex 丰富了NOVUS的产品线,使NOVUS生命科学产品超过20万种。产品线的丰富与完善,将更好地为实验者提供全面和优质的产品与服务。2014年7月2日,Bio-Techne 6千万美元收购Novus Biologicals
代理

Sigma-Aldrich
实验室仪器 / 设备/试剂/耗材
已认证品牌介绍
Sigma-Aldrich 为德国达姆施塔特默克集团(Merck KGaA)或其子公司商标。默克 Sigma-Aldrich® 产品组合提供广泛而深入的实验室和生产材料组合,结合技术支持和科学合作伙伴关系,充分展现了我们共同的科学探索精神。
代理

Thermo Fisher
试剂/实验室仪器 / 设备/耗材
已认证品牌介绍
作为全球科学服务领域的领导者,赛默飞世尔科技进入中国发展已有30余年,在中国的总部设于上海,并在北京、广州、香港、成都、沈阳等地设立了分公司,员工人数超过1400名,服务于第一线的专业人员超过800名。我们的产品主要包括分析仪器、实验室设备、试剂、耗材和软件等,提供实验室综合解决方案。我们服务各行各业的客户,包括医药和生物技术公司、医院和临床诊断实验室、大学、科研院所和政府机构,以及环境与工业过程控制行业等。为了满足中国市场的需求,目前国内已有6家工厂运营。我们分别在北京和上海设立客户体验中心,将世界级的前沿技术、产品和应用展示给国内客户;新成立的中国技术中心结合国内市场的需求和国外先进技术,研发适合中国的技术和产品;遍布全国的维修服务网点和新推出的维修服务中心,提高了售后服务的质量和效率。我们的使命是致力于帮助客户让世界更健康、更清洁、更安全。持续增长的投资和业务是我们履行植根中国、服务中国的承诺;热心投入公益事业,是为了回报社会,成为优秀的企业公民。我们在中国连续多年获得《商务周刊》评选的“100家快公司”、《中国企业报》评选的“跨国公司中国贡献奖”以及“2010年中国社会责任优秀企业奖”等奖项。
代理

Horizon Discovery
细胞库 / 细胞培养/技术服务/动物模型
已认证品牌介绍
Horizon 是一家完全整合的生命科学公司,为从医疗顺序到治疗的医疗保健连续体的每个阶段的客户提供有利的产品,服务和研究计划。Horizon 提供广泛的转基因支持服务,从定制模型生成到菌落扩展,维护和冷冻保存/冷冻恢复服务。我们的转基因支持服务得到顶级研究人员,生物安全设施和畜牧业最佳实践的支持。
代理

Enzo
实验室仪器 / 设备/试剂
已认证品牌介绍
Enzo旗下共有Enzo,Biomol,Alexis Biochemicals,Assay Designs,Stressgen等品牌,为生命科学研究者提供基因组分析,细胞生物学,翻译后修饰,信号转导,肿瘤和免疫学,药物筛选等相关领域的优质产品。Enzo life sciences 的标记技术和检测技术在科学研究和临床诊断这两个领域中处于领先地位。标记探针和染料的强强组合是基因表达分析,核酸检测,蛋白质生物化学研究与检测,分子生物学,细胞分析等研究领域中目标识别/验证和高容量分析实验的强有力工具。 ENZO life sciences 主要产品:Microarray Analysis(生物芯片分析类产品)、Modified Nucleotides(带修饰的核苷)、Nucleic Acid Labeling Systems(核苷酸标记系统)、Monoclonal Antibodies、Human Papillomavirus、Identification Systems(人乳头状瘤识别系统)、In Situ Hybridization And Detection Systems(原位杂交和检测系统)、BioProbe、Labeled Probes(生物标记探针)、Signal Generating Systems(信号发生系统)。
代理

BiosPacific
抗体
已认证品牌介绍
BiosPacific 公司是R&D Systems 旗下专门为临床诊断试剂的研发与生产提供抗原、抗体(多抗、单抗、偶联的抗体、抗体对)的公司,在临床诊断试剂方面非常著名,是临床诊断试剂原料的全球供应商。BiosPacific公司是全球著名的临床诊断抗原抗体原料的供应商,其产品主要集中在癌症(肿瘤)、内分泌、传染病、人血清蛋白、甾类、血管病等标记物的优质单抗、多抗、抗原、偶联抗体,以及抗体对(matched pairs)。
代理

Cayman
抗体/试剂
已认证品牌介绍
Cayman公司成立于1980年,在过去20多年的发展过程中,始终保持着为全球科研工作者提供高质、优价研究产品的宗旨。该公司目前可以提供 2,138 多种生化和免疫试剂,涉及肿瘤、氧化氮、神经学、凋亡、氧化性损伤、内分泌学等研究领域。非常有特色的检测试剂盒包括类花生酸类物质、游离的生物标志、环核苷、激素及氧化氮等。此外,还提供多种高质量试剂,如类花生酸类物质、氧化氮试剂及许多相关脂质、脂肪酸、酶和抗体等。Cayman非常愿意接受各地客户的要求,合成复杂和不稳定分子。 Headquartered in Ann Arbor, Michigan, Cayman Chemical Company supplies scientists worldwide with the resources necessary for advancing human and animal health. Cayman was founded in 1980 by the current CEO, Dr. Kirk Maxey, to demonstrate the value of naturally growing gorgonian corals as a renewable, economically viable source of prostaglandins. Today, Cayman remains committed to its origins and its founding vision: To provide affordable, high-quality biomedical products and to serve the research community.
代理

Bio X Cell
抗体/试剂
已认证品牌介绍
从 1997 年成立以来,Bio X Cell 一直批量生产单克隆抗体(从毫克到克级别)。 我们为从事 in vivo 临床前研究的科研工作者提供超纯的抗体。我们不仅能批量提供结合已知抗原的抗体,也能大量生产结合全新抗原的抗体。我们希望可以通过合理的价格和卓越的技术支持服务,来帮助科学创新研究。我们拥有广泛的抗体产品线,从融合蛋白到同型对照抗体,都非常适合各种 in vivo 和 in vitro 的应用。我们的抗体产品是在无动物系统(组织培养物)里面生产的,然后通过亲和层析纯化的。 这些产品中内毒素含量极少,并且不含任何防腐剂和稳定剂。
代理

R&D Systems
试剂
已认证品牌介绍
R&D Systems作为全球免疫学和细胞生物学产品的领跑者,1976年创立于美国明尼苏达州,至今已为学术界服务近40年。其母公司Bio-Techne(原Techne公司)于1983年在美国NASDAQ上市。目前,R&D Systems拥有近30,000种产品,95%以上由自己研发生产。其产品包括细胞因子、ELISA试剂盒、生长因子、趋化因子、抗体、Animal-Free™蛋白、Luminex 液相芯片、多因子检测固相芯片、流式细胞分析与细胞筛选、干细胞及细胞培养等;覆盖肿瘤、发育、糖生物、内分泌、免疫、神经学、蛋白酶、信号传导等学科研究领域;且每年有近2,000种新产品不断问世,以满足不同科研工作者的研究需要。2007年,R&D Systems China在中国成立,是R&D Systems在中国的全资子公司,全面负责在中国及东南亚地区的技术、销售及售后服务。2011年2月,R&D Systems China的子公司---R&D Systems Hong Kong Ltd.在香港注册并开始运营,负责香港及东南亚地区的营销活动。同年,R&D Systems China与芬兰Medix Biochemica在大中华地区强强合作,开始进军IVD原料供应市场。2011年4月,R&D Systems母公司Bio-Techne,收购了Boston Biochem及Tocris两大强势品牌。Boston Biochem是全球领先的泛素、相关修饰蛋白及通路研究产品专业的开发者和制造者,目前有超过800种的泛素相关产品。Tocris总部位于英国,目前提供超过3000种包括GPCR配体、神经递质、离子通路和信号抑制物等在内的化学小分子和多肽等生命科学研究试剂。 2014年,全球知名抗体生产商Novus,生命科学仪器制造商Protein Sample,中国知名蛋白生产商Primegene(普欣)都陆续加入了Bio-Techne的大家族。
代理

Tocris bioscience
试剂
已认证品牌介绍
Tocris Bioscience是一家专卖生命科学研究chemicals, peptides and antibodies的知名品牌,其产品也广为各大药厂、大学、研究机构,超过五万名科学研究者所采用。 目前,產品內容已超過一千六百種以上,並每年持續不斷的增加新的產品。目前,产品内容已超过一千六百种以上,并每年持续不断的增加新的产品。Tocris bioscience是位于英国布里斯托尔(Bristol)的高品质试剂提供商,共有2000多种产品,主要集中在神经科学和信号传导领域,产品类型包括小分子、多肽、抗体、配体和化合物筛选文库等,主要产品包括GPCR ligands,神经传递素,离子通道调控剂,信号通路抑制剂等,这些产品被广泛选择性地用于阻断或激活生物学通路。Tocris是世界上神经科学研究领域无可争议的领导者,其生产的影响神经系统的化学物质被多次引用,这些物质很多都来自Jeff Watkins(Tocris 的创立人)在Bristol大学原创性的研究工作。
代理

Innova Biosciences
抗体
已认证品牌介绍
Innova Biosciences 公司专注于生物偶联技术(bioconjugation) – 即将两种分子结合在一起形成一个杂合结合物(hybrid conjugate)。这些标记结合物在世界各地的医院及科研机构被广泛使用。Innova 公司开发生产的“一步法”抗体标记试剂盒-Lightning-Link™系列产品极大程度的简化了结合标记流程。同时,Innova 也提供独有的结合物标记优化服务,开发更灵敏的免疫诊断检测。此外,Innova也向药物研发实验室提供一些相关产品。Innova 公司以提供突破性的技术和服务,极大的推动生命科学研究、简化试验流程作为企业的使命。这也必将使Innova 公司成为成为全球生命科学和生物技术行业的领导企业。
代理

Cell Signaling Technology
抗体
已认证品牌介绍
Cell Signaling Technology (CST) 是一家由科学家创立的私营家族公司,致力于提供全球最高品质的创新研究和诊断产品,加速生物学认知以及实现个体化医疗。CST 坚持自主生产和严格验证,其高质量的产品和专业的研发精神已被全球客户认可,被公认/票选为细胞信号研究的金标准、最佳抗体*、研究者的选择*、PTM(蛋白翻译后修饰)年度抗体公司*、十年抗体品牌*等(*来自 CiteAb、LISA 数据报告)。CST 官网(www.cellsignal.cn)
代理

Biovision
试剂
已认证品牌介绍
BioVision 公司是世界顶尖的细胞凋亡和信号传导产品生产商,产品包括检测试剂盒,抗体及重组蛋白,涵盖了细胞凋亡、细胞信号传导和细胞因子研究的各个方面。凋亡产品包括Annexin V 试剂盒、半胱天冬氨酸蛋白酶(Caspases)试剂盒及底物和抑制剂、线粒体膜电位试剂盒、梯状DNA 电泳和TUNEL 试剂盒、凋亡诱导剂、凋亡相关抗体和化学品、细胞增殖检测试剂盒等。Abcam于2021年收购了BioVision,您可以直接在 Abcam 购买 BioVision 产品。自 2022 年 2 月 15 日起,Abcam 将独家销售 BioVision 产品。
代理

Fitzgerald
试剂
已认证品牌介绍
美国Fitzgerald Industries International, Inc.(简称FII公司),专门供应研究和生产体外诊断试剂用原料,产品超过9000多种,主要产品有:1. 免疫比浊法用特种蛋白抗体— ApoAI, ApoB, IgG, IgA, IgM, C3, C4, TRF, CRP, Lp(a), PA, Albumin, β2-Microglobulin, etc;2. 化学发光免疫测定法(CLIA)、酶联免疫测定法(EIA)、放射免疫测定法(RIA)、荧光免疫法(FIA)测定用各类高纯单克隆、多克隆抗体,纯化抗原;3. 癌症系列抗原和抗体,如CA50, CEA, CA, AFP, CA 125, CA15-3, CA19-9, CA72-4, etc;4. 配对抗体和抗原,如性腺,甲状腺系列等。
代理

LifeSpan BioSciences
抗体/试剂
已认证品牌介绍
LifeSpan公司成立于1995年,随着公司的发展,lifespan成为了生物分子病理学方面的领军人物,它的主要产品有抗体,免疫组化方面产品,甚至信息学中的生物数据库。Lifespan在主要药物靶点方面拥有很多独有的抗体产品,而且在研究人体器官组织疾病方面也拥有很多独特的表达性蛋白和抗体LifeSpan 同时也在高通量成像系统和肿瘤识别软件方面的探索和开发有了很大成就,lifespan已经开发出了用于病理学解释,毒理学方面关于毒物潜伏期预测,肿瘤诊断的相关设备和相关软件。现在,lifespan 公司已经在美国,欧洲和日本拥有了超过100家的大型制药企业客户。
代理

AnaSpec
试剂
已认证品牌介绍
AnaSpec是一家由多肽合成、荧光标记、抗体、树脂合成专家团队组成的生物企业,为全世界的科研工作者提供全套的蛋白质组学研究解决方案。产品线主要分三个部分:多肽、检测试剂和树脂等化学试剂,适合基础研究、高通量筛选和药物发现等方面;还提供多肽合成、抗体生产和分析试剂盒开发。能合成不同数量级(mg-g级)的多种长度序列肽,常规合成肽为50个氨基酸或更长。2009年,美国Anaspec公司被Eurogentec收购
代理

Sengenics
试剂/技术服务
已认证品牌介绍
Sengenics 是一家功能蛋白质组学公司,利用其专利的 KREX™ 技术生产全长,正确折叠和功能的蛋白质。KREX™ 是乔纳森·布莱克本(Jonathan Blackburn)教授在剑桥大学任教期间发明并获得专利的。Jonathan 是 Sengenics 的 CSO。 KREX™ 的关键应用是发现了两个核心医疗用例的自身抗体生物标记。首先,将接受自身免疫或癌症药物治疗的患者分为反应者,无反应者和可能表现出严重的免疫相关不良事件的患者。其次,在常规诊断测试之前数年,可用于诊断癌症,自身免疫或神经退行性疾病的自身抗体生物标记物的鉴定。 目前,Sengenics 与十大制药公司中的九家建立了商业合作伙伴关系,共同开发针对自身免疫和癌症免疫疗法药物的补充和伴随诊断测试。该公司已开始为其中的一些测试获得 FDA 510(k)批准的程序,并计划于 2021 年推出。
代理

Cytoskeleton
蛋白质/抗原/多肽/试剂
已认证品牌介绍
Cytoskeleton公司成立于1993年,专注于生物化学和细胞过程研究中的纯化蛋白和便捷试剂盒开发与生产。公司提供药物筛选、信号转导、细胞骨架研究相关的系列试剂盒和产品,尤其以细胞骨架相关研究见长,既能满足于样品较少的科学研究,也可以用于小规模筛选研究和高通量大规模筛选研究。此外,公司还提供微管蛋白,肌动蛋白,小G蛋白,GAPs,GEFs等现有产品的药物筛选服务。
代理

Synaptic Systems
试剂
已认证品牌介绍
Synaptic Systems为神经科学家和细胞生物学科学家提供研究工具,力求为您在神经科学和细胞生物学访方面提供最好的抗体。我们与著名的科学家合作和销售他们的抗体。我们的抗体具有显著特点,并以品质著称。
代理

USBiological
抗体/试剂
已认证品牌介绍
Usbiological公司是美国著名的抗体和生化试剂供应商,生产世界上种类最多的抗体,用于Western Blot、免疫沉淀、免疫荧光、免疫组化和流式细胞术等多种检测方法。Usbiological公司现已拥有超过50,000种抗体、抗原和生化产品,为科研用户提供了诸多 超值选择。
代理

Agrisera
抗体
已认证品牌介绍
瑞典Agrisera公司成立于1980年,长期以来,公司致力于植物/环境科学研究中所需蛋白抗体研发与销售,主要集中于模式之物及其他植物的生理、病理相关的蛋白抗体。Agrisera 公司以提供高品质、优服务在欧洲树立了优秀的品牌形象,并成为瑞典 Umeå Plant Science Centre的抗体供货商,同时还积极拓展全球市场,每年都有大批采用该公司抗体产品的高质量研究论文发表于各类学术刊物,受到全球科研工作者的一致认可。Agrisera的所有抗体分两大类:植物及藻类的抗体,以及细菌、真菌、昆虫、鱼等动物类抗体,植物领域的抗体涵盖Arabidopsis thaliana、Hordeum vulgare、Chlamydomonas reinhardtii、Cyanobacteria、Physcomitrella patens、Oryza sativa、Populus sp、Conifers等多个物种。
代理

Meridian
抗体/试剂
已认证品牌介绍
美国Meridian Life Science公司是一家生产多种抗体,多种病毒抗原,多种重组蛋白质和关键检测试剂、多种分子生物学产品的大型领军企业。同时也为生物制药和体外诊断企业提供研发,生产流程以及制造服务。收购 Bioline 公司后,Meridian Life Science公司增加了包括聚合酶链反应(PCR)在内的分子生物学技术能力及其产品,从而极大充实了其生命科学产品系列。
代理

Miltenyi Biotec
实验室仪器 / 设备/试剂
已认证品牌介绍
德国美天旎生物技术有限公司是Miltenyi Biotec在中国的全资子公司,负 责美天旎产品的销售和相关服务。Miltenyi Biotec以MACS分选技术为广大生命 科学工作者所熟知。历经26年,美天旎产品线不断扩充,已经从细胞磁性分选 金标准的公司成长为拥有从基础科研到临床治疗完整产品线的多元化公司,可 以为客户提供样品制备、细胞分选、流式细胞分析、分子分析、细胞培养和细 胞治疗、免疫吸附治疗相关的试剂、仪器及配套服务。
代理

Alomone Labs
试剂
已认证品牌介绍
Alomone 公司是一家位于耶路撒冷的以色列著名的生物科技公司,专著于提供生命科学细胞生物学试剂和服务。Alomone 公司作为世界上最著名的离子通道专业供应商,它的离子通道抗体是世界上最全的、质量也非常好!目前被世界各地的科学家广泛的使用。
代理

斯达特
抗体/ELISA 试剂盒/试剂
已认证品牌介绍
杭州斯达特是一家集研发、生产、销售与技术服务为一体的高科技生物公司,志在为全球生物医学研究、体外诊断企业、生物制药企业提供优质的抗体、蛋白、试剂盒和定制服务,包括科研抗体、CDx 和 IVD 抗原和抗体原料、一步法 ELISA 试剂盒、鼠兔通用二抗试剂盒以及其他用途的免疫试剂整体解决方案。公司核心团队深耕抗体研发十五年,具有成功开发数千种精准医学抗体、科研抗体的丰富经验。公司建立了多物种单 B 细胞抗体开发平台(兔单抗,鼠类单抗等)、传统鼠单抗、重组蛋白表达平台及完善的抗体应用验证和检测体系(包括免疫层析,酶联免疫,流式分析,免疫组化,免疫印迹,免疫荧光,免疫沉淀等)。已正式通过欧盟 98/79/EC 认证、ISO9001 认证和 ISO13485 认证。公司以加速人类、疾病诊断、为人类和动物健康保驾护航为使命,以扎实的科学技术为基础,秉承向正向善向上的价值观,以行业客户需求为导向,愿与全球同仁精诚合作,共启健康新篇章。斯达特,专注于抗体研发和制造,您的最佳抗体优选伙伴。
代理

Absin
生物化学/抗体
已认证品牌介绍
爱必信(上海)生物科技有限公司 Absin Bioscience Inc. 成立于 2010 年,公司位于浦东新区张江医谷园区,公司以研发、生产和销售自主品牌(Absin® )产品。 我们的目标是为生命科学等相关领域的客户提供全面的的生物化学试剂,目前主要产品:生物化学试剂 60 万种,抗体 10 万种,以及各种特色优质的高性价比产品,我们的产品还在不断丰富和完善中。
代理

LabEx
技术服务
已认证品牌介绍
上海乐备实生物技术有限公司,建立了多种免疫学分析领域的多因子及多组学平台。 已拥有空间多组学、单细胞测序、PCR Array、液相微阵列Luminex、MSD电化学发光、Elispot、蛋白芯片、抗体芯片、CBA多色流式检测、多色免疫组化等超20个多因子及多组学技术平台,为广大科学研究者提供从核酸到蛋白,从细胞到组织,再到空间的多维度检测服务。
代理

Cytiva
实验室仪器 / 设备/试剂/耗材/细胞库 / 细胞培养
已认证品牌介绍
Cytiva(思拓凡)的前身是 GE 医疗生命科学事业部,现在隶属于丹纳赫集团旗下的生命科学平台。作为全球生命科学领域的领先者,Cytiva(思拓凡)致力于促进与加速全球医疗的发展。Cytiva(思拓凡)年销售额超过 33 亿美元,,并在全球 40 多个国家拥有近 7000 名员工。作为值得信赖的合作伙伴,Cytiva(思拓凡)全面助力客户提升研究与生产流程中的速度、效率与能力,赋能创新型药物的发展和生产,惠及全球患者。
- 上海优宁维生物科技股份有限公司
- >技术资料
- >
文献解析|聚焦!可用于鼠源 T 细胞改造的 AAV 亚型全解析
技术资料/正文
文献解析|聚焦!可用于鼠源 T 细胞改造的 AAV 亚型全解析
209 人阅读发布时间:2025-02-14 14:52
在生命科学的前沿领域,T 细胞基因组修饰改造宛如一把神奇的钥匙,悄然开启了一扇重新审视 T 细胞发育进程与功能机制的全新大门。回首往昔,工程化改造后表达嵌合抗原受体(CAR)的 T 细胞,恰似医学战场上的新锐 “尖兵”,在恶性血液肿瘤治疗的 “阵地” 成功突围,立下赫赫战功,如今更是踌躇满志,剑指实体瘤治疗这片更具挑战的 “战场”,试图续写传奇。
传统的重组基因递送手段,往往倚重复制缺陷型的逆转录病毒,γ- 逆转录病毒(gRVs)和慢病毒便是其中的 “主力军”。它们如同肩负特殊使命的 “投递员”,兢兢业业地将基因 “包裹” 半随机地嵌入目标基因组之中。然而,理想很丰满,现实却很骨感,前行之路布满荆棘,“位置效应” 这个 “拦路虎” 横亘眼前,引发了一系列棘手难题:T 细胞功能参差不齐、转基因陷入沉默 “困境”,甚至有因插入操作不慎而诱发癌症的风险,犹如高悬在免疫治疗安全性与有效性头顶的 “达摩克利斯之剑”,让研究者们忧心忡忡。
值此困局,基因编辑技术宛如划破暗夜的曙光,带来了破局之策。精准整合转基因的策略应运而生,像是在微观世界里精心布局的 “棋局”,在 TCRα 恒定区(TRAC)位点巧妙植入 CAR,如同为 T 细胞注入 “强心剂”,使其抗肿瘤活性大幅跃升;巧妙重塑 TCR 特异性,以 HLA 依赖的独特方式,精准锁定细胞表面抗原,展现出卓越的靶向打击能力。可对于 T 细胞研究而言,要想如实映射肿瘤微环境错综复杂的 “生态”,以及自身免疫那微妙且关键的 “生态位”,非得借助免疫功能健全的模型不可,而当下,寻觅一种既高效又毫无毒性隐患、专用于鼠源 T 细胞基因整合的方法,却恰似 “大海捞针”,难觅踪迹。
核酸转染(Nucleofection)TALEN 或 Cas9 手段登场,虽可在基因敲除 “舞台” 一展身手,却在面对同源导向修复模板(HDRT)递送、进行大片段敲入任务时 “败下阵来”,显得力不从心。往昔,AAV6 在人源 T 细胞领域曾大放异彩,凭借较高的效率与较低的毒性,将 HDRT 稳稳导入,备受赞誉;反观鼠源 T 细胞这边,同样的 “战术” 却遭遇 “滑铁卢”,核酸转染 ssDNA 或 dsDNA HDRT 时,编辑效率如 “强弩之末”,不足 10%,还伴随着令人咋舌的高毒性,超半数乃至高达 85% 的细胞无奈折戟沉沙、走向死亡,这般鲜明反差,着实令人唏嘘。
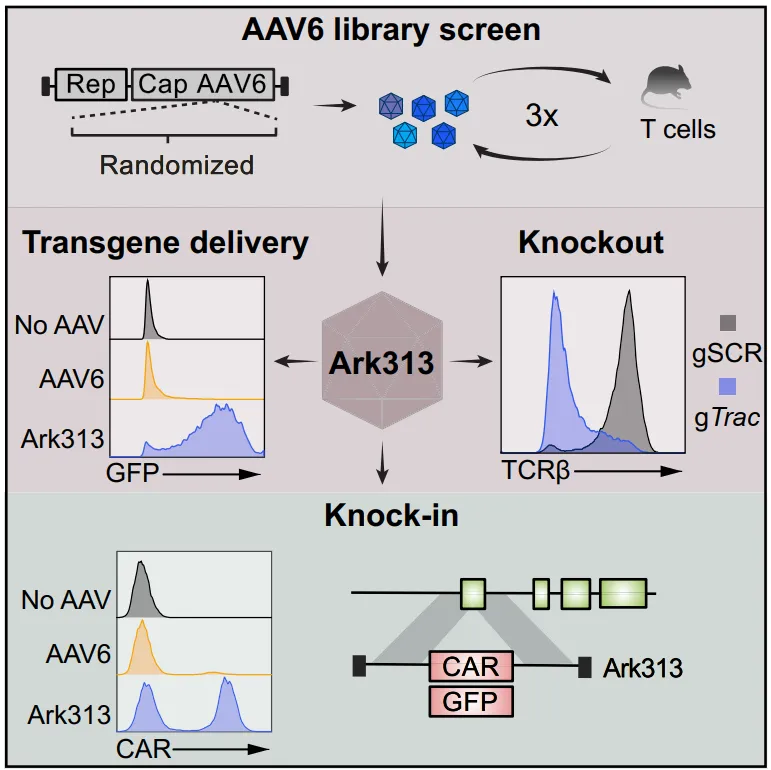
好在 AAV 自身蕴藏着无限潜力,犹如一座亟待挖掘的 “宝藏”,虽暂时缺乏特异性靶向鼠源 T 细胞的理想载体,但科学界怎会轻易言弃?诸多科研志士纷纷踏上探索征程,各施妙法对 AAV 展开改造之旅。这不,杜克大学 Aravind Asokan 团队脱颖而出,凭借独辟蹊径的奇思妙想 —— 让 AAV 衣壳蛋白文库历经感染循环的 “磨砺”,成功实现 AAV 亚型的受体转换,恰似一场微观世界里的 “华丽变身”,为后续突破埋下伏笔。
近日,Asokan 团队与加州大学旧金山分校的 Justin Eyquem 团队强强联手,在《Cell》这一科研 “高光舞台” 重磅登场,携创新性成果惊艳亮相。他们借助饱和突变文库筛选这把 “利刃”,对 AAV6 精心雕琢、深度改造,成功孕育出特异性锁定鼠源 T 细胞的 “利器” Ark313,紧接着,全基因组敲除筛选的 “火眼金睛” 锁定了 Ark313 的必需宿主因子 QA2。这一全新的 AAV 变体 Ark313,宛如拥有神奇 “魔力”,无需借助核苷转染,便能游刃有余地完成 DNA 递送任务,CRISPR - Cas9 介导的敲除操作在它手中如同 “小菜一碟”,大型基因的靶向整合更是不在话下。尤为值得一提的是,依托 Ark313 精心构建的靶向 Trac 的 CAR - T 模型,在小鼠实体瘤治疗的 “实战演练” 中尽显优势,大放异彩,恰似一颗璀璨新星照亮了细胞治疗效率提升与 T 细胞免疫进阶的前行之路,为未来相关研究与临床应用注入了磅礴动力与无限可能。

在探索高效改造鼠源 T 细胞的漫漫征程中,科研团队精心谋划、步步为营,开启了一场独具匠心的科研攻坚行动。其开篇布局便是以 AAV6 为基石,匠心独运地搭建起一座衣壳蛋白文库,恰似构筑一座微观的 “基因实验室”。在这个特殊的基因架构里,融合了 AAV2 的 Rep 基因、AAV6 的 Cap 基因以及 AAV2 的倒末端重复(ITR),共同编织成假病毒型 AAV2/6 基因组,而饱和突变的 “魔法棒” 则精准挥动在衣壳蛋白 VP3 亚基那关键的可变区 IV(454 - 460)之上。为何偏偏选中此地?只因这片微小区域肩负着 “先锋使命”,主宰着宿主细胞入侵的 “战略要冲”,还牵连着中和抗体诱导的微妙机制,堪称整个行动的 “关键突破口”。
筛选舞台搭建于 C57BL/6J 小鼠脾细胞衍生的原代 T 细胞 “阵地”,历经三轮紧张且精密的感染循环 “洗礼”,恰似沙里淘金般,一个单一优势突变体 ——Ark313 崭露头角,其身上带着独有的 “身份标识”:454 - VVNPAEG - 460 氨基酸替换烙印,自此步入科研舞台中央。紧接着,细致入微的对比分析拉开帷幕,一番严谨探究后发现,Ark313 与 AAV6 在病毒滴度这场 “指标竞赛” 中难分伯仲,旗鼓相当;然而,一旦聚焦于对鼠源 T 细胞的 “亲和攻势”,Ark313 则宛如身怀绝技的 “特种兵”,在结合、吸收比例以及转导效率等关键 “战术指标” 上完胜 AAV6,这般鲜明差异,无疑暗示着鼠源 T 细胞内部潜藏着某种神秘的特异性宿主因子,恰似一位隐匿幕后的 “引路人”,暗中助力 Ark313 一路 “攻城略地”,高效完成结合与吸收任务。
锁定目标后,探寻 Ark313 背后 “神秘帮手” 的行动旋即展开。科研人员祭出基于流式细胞术的全基因组 CRISPR 敲除筛选 “神器”,在那些活跃表达 Cas9 的鼠源 T 细胞 “阵营” 里,悄然植入携带着全基因组范围 sgRNA 文库的 γ - 逆转录病毒库,恰似埋下一颗颗 “智能探针”。随后,引入可表达 GFP 的 Ark313 载体,借由荧光强度这一 “信号灯” 精准分选细胞,紧接着历经基因组 DNA 提取、PCR 扩增等一系列精密 “工序”,最终成功锁定 15 个候选基因。细细审视这份 “基因清单”,既有 AAU040320、Gpr108 这类早已在 AAV 转导领域声名在外的 “熟面孔”,也不乏 B2m、H2 - Q7、H2 - Q6 等与 MHC 复合物紧密相连的 “关键角色”。值得一提的是,H2 - Q7、H2 - Q6 协同 H2 - Q8、H2 - Q9 共同编码 QA2 这一蛋白类群,恰似一群默契配合的 “基因队友”。有趣的是,H2 - Q7 作为一种 GPI - 锚定的细胞表面蛋白,身旁还簇拥着诸多 GPI 加工相关基因,如 Gpaa1,恰似众星捧月一般。层层剖析、抽丝剥茧之后,真相浮出水面:MHC I 类分子 QA2 正是 Ark313 转导不可或缺的 “幕后功臣”。
为夯实这一结论,科研人员乘胜追击,采用核酸转导的激活型 T 细胞作为 “验证先锋”,逐一检验敲除筛选基因对 Ark313 转导效率的影响。果不其然,当 B2m、H2 - Q7 或 Aavr 遭遇敲除 “变故” 时,Ark313 的转导效率仿若折翼之鸟,直线下降;更妙的是,一旦 GPI 锚定这一 “根基” 被破坏,转染效率更是如坠寒冬,锐减数倍之多。铁证如山,确凿无疑地证实了 GPI 锚定的蛋白 H2 - Q7 就是 Ark313 紧密结合并顺利转导鼠源 T 细胞的 “必备钥匙”。不仅如此,通过 Ark313 转导不同 QA2 表达水平的鼠源细胞这一 “对比试验”,再次印证 QA2 在整个转导进程中的关键地位。尤为令人安心的是,体内实验传来佳音,Ark313 转导作业并不会干扰 MHC I 类分子正常 “履职”,也不会对 T 细胞植入(engraftment)造成负面影响,犹如一位技艺高超且行事稳妥的 “工匠”,在微观世界里精细操作,却不给整体 “生态” 添乱。
初战告捷后,科研团队马不停蹄,大胆尝试启用 Ark313 操刀鼠源 T 细胞的基因编辑 “手术”。首战告捷,Ark313 不负众望,稳稳当当地递送靶向 Trac 的 sgRNA 表达组件,流式细胞检测数据熠熠生辉,敲入率一路飙升至 84%,展现出卓越的 “投递” 能力;紧接着深度排查潜在风险,惊喜发现其导致双链断裂(DSB)的几率微乎其微,仅在不足 0.6% 的罕见情形下才会出现,恰似一位行事谨慎、极少犯错的 “精密工匠”,将非特异性整合风险牢牢把控在极低水平。再探其递送大片段 DNA 货物的 “负重” 能力,Ark313 再度惊艳全场,对 HDRT(如 GFP 表达基因)的敲入效率一骑绝尘,可达 30% - 50%,远远将 AAV6 那不足 10% 的效率甩在身后。更为精妙的是,当把 sgRNA 与 HDRT 巧妙安置在同一载体之上携手 “出征” 时,敲入效率得以稳稳维持,同时巧妙规避了核酸转导引发的毒性 “暗礁”,一举两得。这般出色表现意味着 Ark313 具备在鼠源 T 细胞中实现瞬时高效递送与靶向基因整合的 “双栖” 能力,恰似一位全能型 “指挥官”,能在微观战场上统筹兼顾,一步到位,为 T 细胞大规模生产打通 “任督二脉”,无论是体内实战还是体外演练,都能大展身手。
志得意满之际,科研团队剑指肿瘤免疫治疗这一 “终极战场”,试图借助 Ark313 施展 T 细胞改造 “魔法”。精心设计靶向 Trac 外显子 1 的 HDRT,以此为 “载体” 搭载免疫治疗用的转基因整合受体(诸如靶向人源 CD19 的鼠源 CAR、靶向 hCD19 的 HIT、或 Trg OT - I TCR)奔赴 “前线”。实战检验成果斐然,CAR 的敲入效率高歌猛进,一举攀升至 75%,靶向 hCD19 的 T 细胞更是如虎添翼,对表达抗原的细胞发起凌厉 “攻势”,细胞毒性显著彰显。科研人员艺高人胆大,更进一步测试使用两个独立的 Ark313 载体分别靶向 Clta 和 Trac 基因,战果辉煌,超 8% 的细胞顺利实现双敲入,充分展露 Ark313 在应对 T 细胞复杂改造任务时游刃有余的 “大师风范” 与深厚潜力。
收官之战,科研团队精心打造 Ark313 构建的 Trac - CAR - T 细胞与传统 gRV 构建的常规 CAR - T 细胞两支 “战队”,二者皆表达相同的 h19m28z,在 C57BL/6J 小鼠体内搭建 LL2 - hCD19 肿瘤模型 “战场”,模拟真实对抗场景。9 天后,两支 “战队” 依次登场,展开激烈角逐。战况揭晓,gRV - CAR - T 细胞铩羽而归,在提升小鼠生存率这场 “硬仗” 中毫无建树;反观 Trac - CAR - T 细胞则大放异彩,如同一把利刃,精准削减肿瘤尺寸,小鼠存活率直线攀升,成为当之无愧的 “赢家”。平行实验佐证有力,Trac - CAR - T 治疗组肿瘤重量锐减,每毫克肿瘤组织中的 CAR - T 数目以及抽取的淋巴结中总 CAR - T 细胞数均显著上扬,如同节节胜利的 “凯旋之师”。更令人惊喜的是,历经抗原刺激 “洗礼” 后,两支 “战队” 虽表面 CAR 表达量初期均有所下滑,直至回归基线水平,但 Trac - CAR - T 细胞却能迅速 “重振旗鼓”,在二次刺激后 CAR 恢复表达速度更快,中心记忆表型亦显著升高,恰似一位经验丰富、愈战愈勇的 “老将”,展现出卓越的持久战斗力。
回顾这场科研征途,科研团队凭借结构为指引的进化妙法与基因组范围的精细筛选 “双剑合璧”,成功挖掘出 AAV6 变体 Ark313,在宿主因子 QA2 的鼎力协助下,于鼠源 T 细胞这片 “战场” 纵横驰骋,高效实现基因递送、编辑与 T 细胞改造等一系列 “高难度动作”。尤为瞩目的是,靶向 Trac 的 CAR - T 细胞改造方案在小鼠实体瘤治疗 “实战” 中,力压传统逆转录病毒法,脱颖而出。这一创新性 AAV 变体的横空出世,无疑为小鼠体内 T 细胞改造事业开辟出一条充满希望与无限可能的崭新路径,恰似一盏明灯,照亮未来肿瘤免疫治疗前行方向。
| 名称 | 货号 | 规格 |
| Neuropeptide S (Mouse) | abs45152600-5mg | 5mg |
| 重组表达的鼠源RNase抑制剂 | abs60249-10000U | 10000U |
| Anti-FAT1 抗体 | Bulk-FAT1-1mg | 1mg |
| Anti-FAT1 抗体 | Bulk-FAT1-3mg | 3mg |
资料格式:
查看详细文档1.png
在线沟通
我的询价







