上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|细胞感应外界营养变化的新机制
115 人阅读发布时间:2025-04-16 11:09
引言
细胞作为生命的基本单位,常常处于各种应激压力环境下。这些压力可能来源于外部环境的变化,如营养物质的浓度波动、温度的变化、氧化应激等,也可能来源于细胞内部的代谢异常。为了维持细胞稳态和细胞生长,细胞需要不断地适应这些变化,通过重塑转录组来应对环境中的营养变化和代谢压力。表观遗传修饰作为一种重要的调控机制,可以动态地调控基因表达,使细胞能够响应外界环境的改变。
近年来,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室的李珊珊和余希岚团队在表观遗传学和细胞代谢领域取得了重要进展。他们通过一系列的研究,揭示了细胞感知并响应外界营养变化的新机制。本文将详细解析他们最近在Nature Communications上发表的研究论文“Phosphorylation of Jhd2 by the Ras-cAMP-PKA(Tpk2) pathway regulates histone modifications and autophagy”,以期为读者提供一个清晰、全面的理解。

背景知识
在解析这篇论文之前,我们需要了解一些背景知识。首先,表观遗传修饰是指不改变DNA序列的情况下,通过调控基因表达来影响细胞功能和特性的机制。其中,组蛋白修饰是表观遗传修饰的重要组成部分,包括组蛋白的甲基化、乙酰化、磷酸化等。这些修饰可以影响染色质的结构和稳定性,从而调控基因的转录活性。
其次,H3K4me3是一种保守的组蛋白修饰,它在基因转录、DNA复制和修复中起关键作用。据报道,H3K4甲基化缺陷与多种病理密切相关,如急性髓细胞性白血病(AML)。在酿酒酵母中,H3K4me3被含有SET结构域的组蛋白甲基转移酶Set1催化,并被含有JmjC结构域的去甲基化酶Jhd2去甲基化,从而调节减数分裂后基因的转录。
然而,尽管我们知道H3K4me3在基因表达调控中的重要性,但关于其如何响应外界营养变化的机制仍不完全清楚。为了解答这一科学问题,李珊珊和余希岚团队展开了深入研究。
研究内容
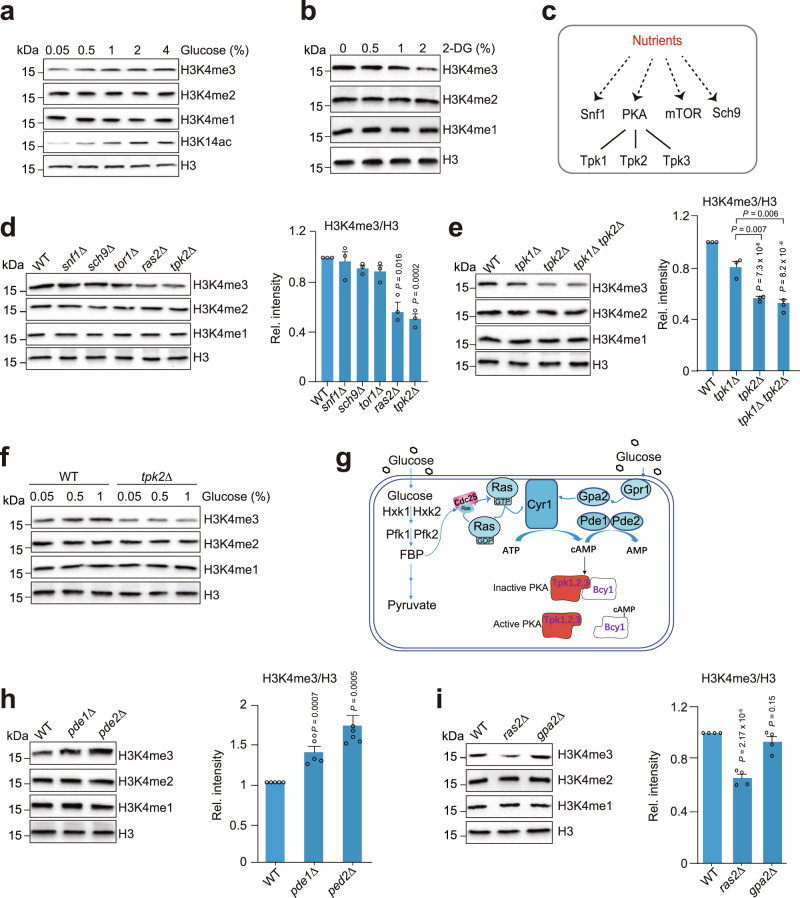
在这项研究中,李珊珊和余希岚团队通过筛选、质谱以及生化技术,发现葡萄糖通过激活PKA蛋白激酶家族的催化亚基Tpk2来抑制组蛋白去甲基转移酶Jhd2的酶活性,促进细胞里的组蛋白H3K4三甲基化(H3K4me3),进而调控细胞自噬和衰老。
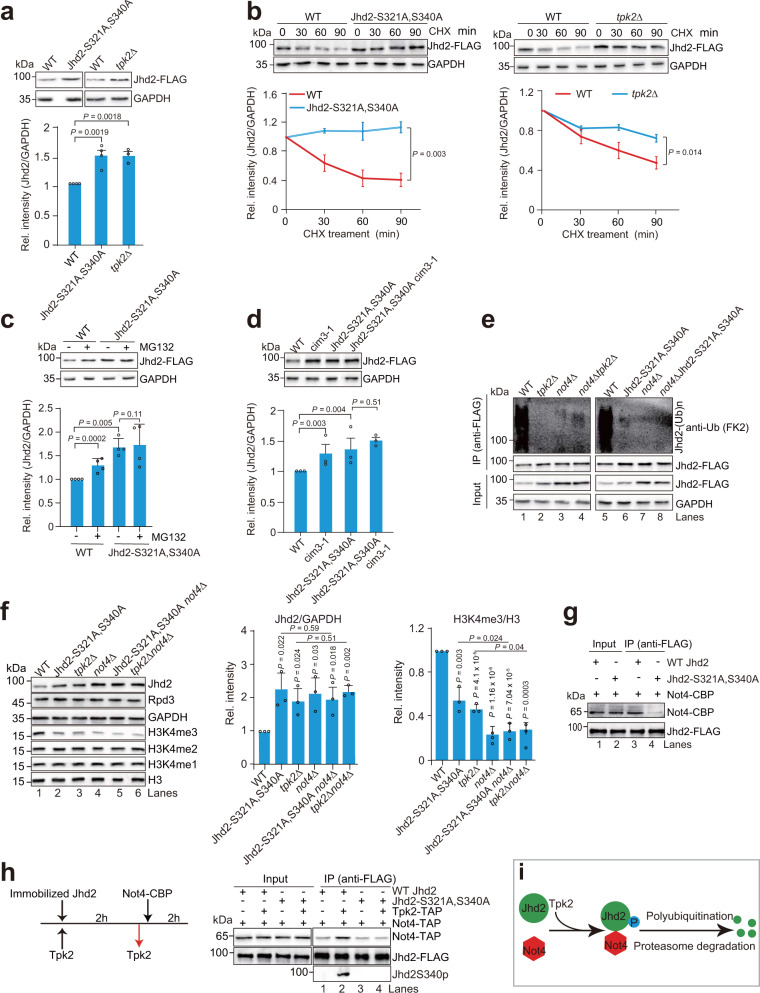
首先,他们通过筛选技术确定了葡萄糖可以激活PKA蛋白激酶家族的催化亚基Tpk2。PKA作为一种重要的信号分子,在细胞代谢和基因表达调控中发挥着重要作用。他们进一步通过质谱和生化技术发现,激活的Tpk2可以催化组蛋白去甲基化酶Jhd2的磷酸化。这一发现揭示了葡萄糖与Jhd2磷酸化之间的直接联系。
接下来,他们深入研究了Jhd2磷酸化对细胞功能和特性的影响。由于Tpk2催化的Jhd2磷酸化位点位于Jhd2的核定位信号序列上,因此Tpk2催化的Jhd2磷酸化可以抑制Jhd2的细胞核定位。这意味着磷酸化的Jhd2无法进入细胞核,从而无法结合到染色体上并发挥其去甲基化酶活性。
此外,他们还发现Tpk2催化的Jhd2磷酸化还可以促进Jhd2被泛素-蛋白酶体降解。泛素-蛋白酶体系统是一种重要的蛋白质降解途径,在细胞代谢和基因表达调控中发挥着重要作用。通过促进Jhd2的降解,Tpk2可以进一步提高细胞里的组蛋白H3K4me3水平。
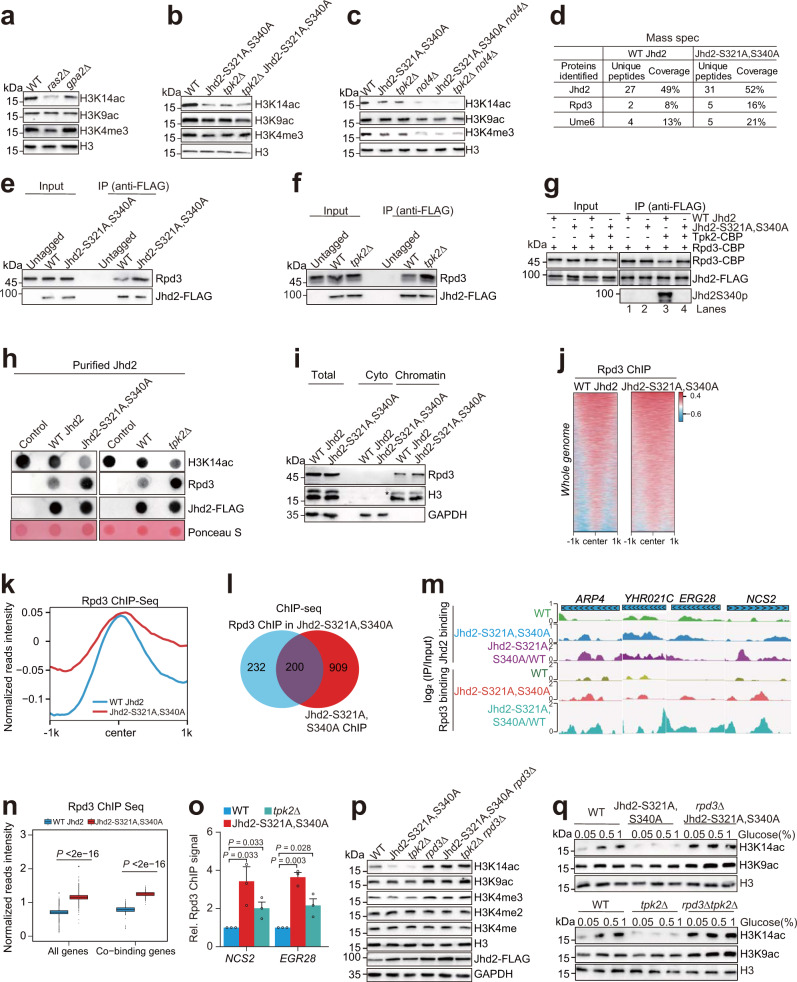
为了验证这些发现,他们进行了生物信息学分析。分析结果显示,Tpk2催化的Jhd2磷酸化在调控细胞自噬与细胞寿命中起重要作用。在低浓度葡萄糖条件下,Jhd2结合在染色体上抑制自噬基因转录;随着葡萄糖浓度的增加,Tpk2磷酸化Jhd2的活性增强,导致Jhd2被泛素化降解,从而维持细胞的基础自噬水平以及正常的时序性寿命。
研究意义
这项研究揭示了代谢与组蛋白修饰之间的直接联系和细胞感应外界营养变化的新机制。通过证明Ras-cAMP激活PKA(Tpk2)磷酸化Jhd2以促进H3K4me3,他们确定了营养反应途径和组蛋白修饰之间的直接联系。这一发现不仅为我们理解细胞如何感知并响应外界营养变化提供了新的视角,也为开发针对代谢性疾病和肿瘤的治疗策略提供了新的思路。
首先,这项研究揭示了葡萄糖代谢与组蛋白修饰之间的直接联系。葡萄糖作为细胞的主要能源物质,其代谢过程对细胞的生长和分裂至关重要。通过调控葡萄糖代谢过程中的信号分子(如PKA),细胞可以动态地调控组蛋白修饰水平,从而适应外界环境的变化。这一发现为我们理解细胞代谢与基因表达调控之间的相互作用提供了新的视角。
其次,这项研究揭示了细胞感应外界营养变化的新机制。细胞通过感知葡萄糖浓度的变化,可以调控Jhd2的磷酸化和降解,从而改变组蛋白H3K4me3水平,进而调控细胞自噬和衰老。这一机制不仅有助于细胞适应外界环境的变化,还可能参与多种疾病的发生和发展过程。因此,通过调控这一机制,我们有望为代谢性疾病和肿瘤的治疗提供新的策略。
最后,这项研究还为表观遗传学领域的研究提供了新的思路和方法。通过结合筛选、质谱和生化技术,他们成功地揭示了葡萄糖代谢与组蛋白修饰之间的直接联系。这一方法不仅具有高度的敏感性和特异性,还可以为其他表观遗传修饰的研究提供借鉴和参考。
未来展望
尽管这项研究已经取得了重要的进展,但仍有许多问题有待进一步探讨。例如,除了葡萄糖之外,其他营养物质是否也能通过类似的机制调控组蛋白修饰和细胞功能?不同营养物质之间的相互作用是否会影响这一机制的调控效果?此外,这一机制在疾病发生和发展过程中的具体作用仍需进一步深入研究。
为了解答这些问题,我们可以采取以下措施:首先,通过筛选和鉴定更多的代谢物和相关信号分子,我们可以揭示更多营养物质与组蛋白修饰之间的直接联系;其次,通过构建疾病模型并进行深入研究,我们可以探讨这一机制在疾病发生和发展过程中的具体作用;最后,通过开发针对这一机制的靶向药物或干预策略,我们可以为代谢性疾病和肿瘤的治疗提供新的思路和方法。
结论
综上所述,李珊珊和余希岚团队在Nature Communications上发表的研究论文“Phosphorylation of Jhd2 by the Ras-cAMP-PKA(Tpk2) pathway regulates histone modifications and autophagy”揭示了细胞感应外界营养变化的新机制。通过证明葡萄糖通过激活PKA蛋白激酶家族的催化亚基Tpk2来抑制组蛋白去甲基转移酶Jhd2的酶活性,促进细胞里的组蛋白H3K4三甲基化(H3K4me3),进而调控细胞自噬和衰老,他们为我们理解细胞如何感知并响应外界营养变化提供了新的视角。这一发现不仅具有理论意义,还为开发针对代谢性疾病和肿瘤的治疗策略提供了新的思路和方法。未来,我们将继续深入研究这一机制的具体作用及其在疾病治疗中的应用前景。
| 名称 | 货号 | 规格 |
| Rabbit anti-CBP Polyclonal Antibody | abs130593-50ug | 50ug |
| Rabbit anti-CBP Polyclonal Antibody | abs130593-100ug | 100ug |
| Histone H2B (D2H6) Rabbit mAb | 12364S | 100ul |
| Acetyl-Histone H3 (Lys9) (C5B11) Rabbit mAb | 9649S | 100ul |



































