上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|肉瘤形成新机制:NFκB途径上调与YAP1靶标USP31抑制及表观遗传疗法探索
145 人阅读发布时间:2025-07-24 10:04
YAP1-Mediated Suppression of USP31 Enhances NFκB Activity to Promote Sarcomagenesis
研究背景
迄今为止,大多数成人软组织肉瘤中尚未发现明确的致癌驱动突变,这导致这些肿瘤对现有的靶向治疗策略普遍不敏感。未分化多形性肉瘤(UPS),作为一种具有高度侵袭性的肿瘤类型,尤其常见于骨骼肌组织中。研究表明,Hippo通路的失调以及该通路转录效应物Yes相关蛋白1(YAP1)的异常稳定,在UPS中能够促进细胞增殖和肿瘤发生。然而,关于这种失调状态如何驱动肿瘤形成的下游机制,目前仍不完全清楚。
摘要
本研究旨在探索肉瘤形成的替代机制,以期发现潜在的治疗干预手段。通过利用本土小鼠模型和全基因组分析技术,研究者发现YAP1在某些肉瘤中呈现组成型活性,而这种活性的维持是由于其抑制剂血管动蛋白(AMOT)发生了表观遗传沉默。值得注意的是,使用表观遗传调节剂伏立诺他和JQ1能够恢复AMOT的表达和Hippo通路的正常信号传导,进而诱导肌肉分化程序并有效抑制肉瘤的形成。此外,研究者还发现YAP1通过抑制泛素特异性肽酶31(USP31)的表达来促进肉瘤形成,而USP31是一种新发现的NFκB信号上游负调节因子。与表观遗传调节剂的联合治疗能够恢复USP31的表达,从而降低NFκB的活性。这些研究结果不仅揭示了UPS中一个关键的潜在分子机制,还证明了表观遗传方法在肉瘤治疗中的潜在应用前景。
研究内容
Hippo通路的失调与肌源性肉瘤亚型之间存在关联,但关于其下游机制的具体细节仍不清楚。尽管研究者仅能获得有限的TCGA患者样本,但分析结果显示YAP1的表达与人类UPS患者的长期存活率之间存在显著相关性。为了验证这些发现的相关性,研究者通过人类活检组织微阵列的免疫组化(IHC)评估了YAP1在各种肉瘤中的表达情况。结果显示,与包括骨骼肌和平滑肌在内的正常间充质组织相比,YAP1在肌肉UPS中的表达水平特别高。
为了进一步研究YAP1在肉瘤中的功能,研究者通过向右侧腓肠肌注射表达Cre重组酶的腺病毒来诱导肿瘤形成。Cre重组酶能够激活致癌Kras的表达并抑制受感染的肌肉祖细胞中的p53表达。在这种模型中,Yap1蛋白的表达在Kras/p53(KP)肿瘤中保持稳定,这为使用该模型研究Yap1在肉瘤中的功能提供了理论基础。通过蛋白质印迹和IHC分析,研究者证实了Kras/p53/Yap1(KPY)肿瘤中Yap1的缺失。当KPY肿瘤达到预定大小或在注射腺病毒后达到特定时间点时,研究者收获了肿瘤样本进行分析。结果显示,Yap1的缺失显著延迟了肿瘤的发生和生长,部分小鼠甚至从未出现可见的肿瘤。此外,KPY肿瘤的增殖率也降低了约50%。
为了深入探究Yap1在UPS中的功能作用,研究者对5个独立的KP和KPY肿瘤进行了微阵列分析。基因集富集分析(GSEA)结果显示,“TNFa诱导的NFκB”信号在KPY肿瘤中显著降低。进一步利用TCGA肉瘤数据集的分析表明,YAP1依赖的NFκB靶标PHLDA1与UPS中较差的存活率相关。这些发现提示YAP1对TNFa介导的信号传导具有特定影响,表明UPS肿瘤微环境中可能存在高水平的TNFa细胞因子产生,从而激活下游NFκB信号传导。
为了验证UPS肿瘤组织中的TNFa表达并确定其来源,研究者对KP肿瘤和分离的肿瘤相关巨噬细胞(TAM)进行了分级。已知TAM会产生大量的TNFa,因此研究者比较了分离的KP肿瘤细胞和TAM中的TNFa表达水平。结果显示,TAM中的Tnfam RNA表达水平比肿瘤细胞中高约45倍。这些数据表明,KPTAM产生了足够量的TNFa以激活NFκB信号传导。然而,研究者也指出,NFκB信号可能受到其他机制的调控。为了测试Yap1在体外控制NFκB活性的能力,研究者使用了已建立的荧光素酶报告基因测定法。源自KP肿瘤的肉瘤细胞被感染了GFP标记的NFκB报告基因结构,然后用表达对照或Yap1 shRNA的慢病毒感染。结果显示,与处理后的对照shRNA表达细胞相比,在用TNFa处理的Yap1 shRNA表达细胞中,NFκB活性降低了约50%。这些发现进一步支持了YAP1在UPS中通过调控NFκB信号传导促进肉瘤形成的机制。
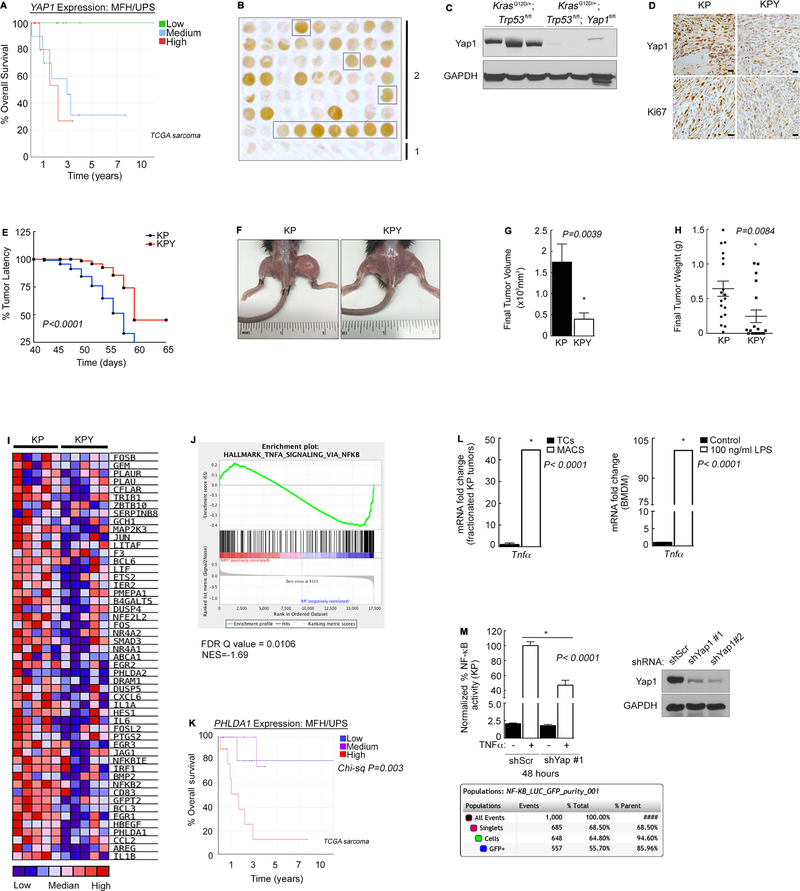
研究者为了更全面地评估人类未分化多形性肉瘤(UPS)组织中核因子κB(NFκB)的活性,采用了一种更大规模的方法。他们对20个独立的人类骨骼肌UPS肿瘤切片进行了免疫组化(IHC)分析。通过检测活性NF-κB(以磷酸化p65/p-p65表示)和YAP1蛋白的水平,研究者发现这两种蛋白在大约80%的肿瘤样本中高表达,相比之下,它们在正常的相邻肌肉组织中的表达水平较低。
为了进一步确认UPS中NFκB信号传导的功能重要性,研究者在Kras/p53(KP)细胞中利用短发夹RNA(shRNA)技术抑制了Rela(NFκB的一个亚单位)的表达。具体而言,Relash RNA#1导致Rela的表达减少了大约50%。随后,研究者将对照细胞和Rela shRNA表达的KP细胞皮下植入裸鼠体内以观察肿瘤生长情况。结果显示,Rela的缺失显著减小了最终肿瘤的体积和重量。
基于上述发现,研究者推测肉瘤细胞可能对NFκB抑制剂敏感。为了验证这一假设,他们比较了用两种独立的NFκB抑制剂——咖啡酸苯乙酯(CAPE)和BAY11-7085——处理的KP细胞与类似处理的HCT-116结肠直肠癌细胞的增殖情况。HCT-116细胞是已知对NFκB抑制特别敏感的细胞系。结果表明,KP细胞对CAPE抑制的敏感性是HCT-116细胞的两倍,而对BAY11-7085的敏感性则是HCT-116细胞的三倍。
综上所述,这些研究结果表明NFκB活性在促进UPS生长方面起着重要作用,并且YAP1的表达与人类UPS中NFκB的上调密切相关。这些发现不仅加深了对UPS发病机制的理解,还为开发针对该疾病的新型靶向治疗策略提供了潜在的靶点。
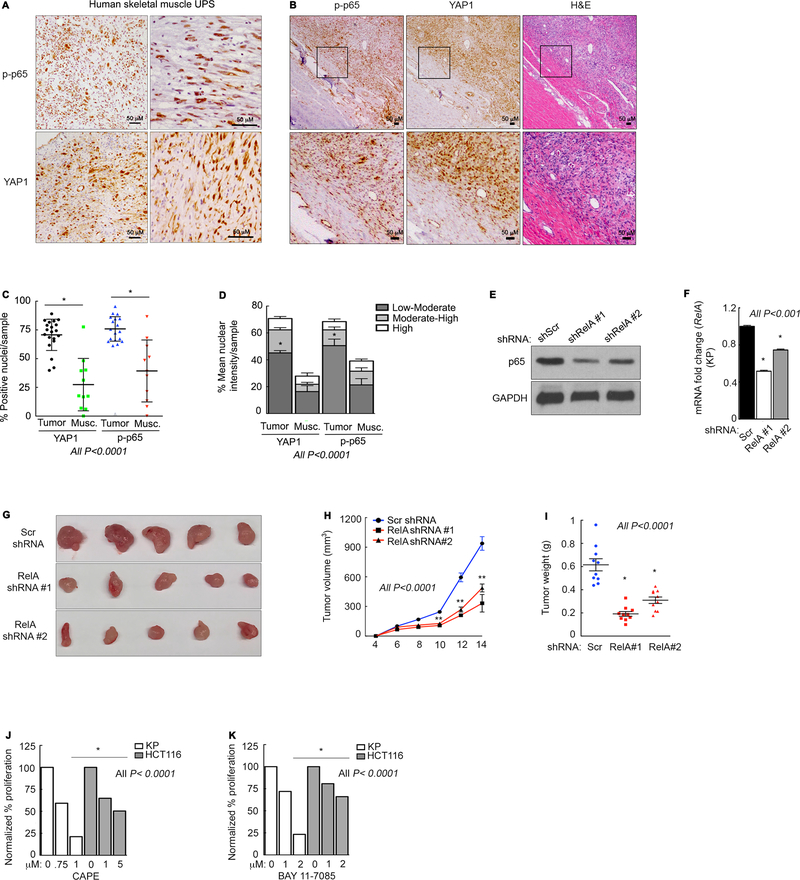
研究者深入探索了表观遗传疗法将肉瘤细胞诱导分化为恶性程度较低的肌肉样细胞的潜力。他们首先以正常成肌细胞分化的C2C12鼠模型为研究对象,评估了NFκB信号传导在其中的作用。具体而言,研究者将未分化的C2C12成肌细胞置于分化培养基(DM)中处理长达6天,并监测了分化标志物的表达、NFκB靶标的表达以及肌管的形成情况。结果显示,在第6天,分化标志物(包括Myh1、Myh2、Mef2c和Myh3)均显著上调,这与观察到的肌管形成现象相一致。
此外,研究者还观察到YAP1依赖性的NFκB靶标Ccl2和Hbegf的表达随时间呈现振荡模式,这与他们之前观察到的NFκB荧光素酶活性变化相吻合。然而,在生长培养基(GM)中增殖的C2C12细胞中,这些YAP1介导的NFκB靶点/调节剂(如Ccl2、Hbegf、Areg和Phlda1)在3天内并未表现出振荡现象。当细胞汇合并开始表达分化标志物后,研究者便无法再准确测量与增殖相关的基因表达。
接下来,研究者评估了这些靶标在经SAHA/JQ1处理的Kras/p53(KP)细胞中的表达情况,并观察了它们是否与成肌细胞分化相关的振荡现象相似。有趣的是,他们发现无论是在SAHA/JQ1处理的KP细胞中,还是在分化的C2C12细胞中,NFκB靶标的表达都并未呈现同步振荡,这表明靶标的表达时间可能受到特定NFκB辅因子产生的调控。
研究者的数据进一步表明,肉瘤细胞的表观遗传治疗能够恢复在分化成肌细胞中观察到的NFκB振荡现象。与这一假设相一致的是,SAHA/JQ1处理的KP细胞在形态上与对照细胞或单独药物处理的细胞存在显著差异。为了确定肌肉分化程序是否被转录诱导,研究者通过微阵列分析比较了DMSO处理和SAHA/JQ1处理的KP细胞之间的基因表达差异。Metascape分析显示,DMSO处理的细胞中富集的基因与细胞周期和细胞分裂过程最为显著相关,而SAHA/JQ1处理的细胞中富集的基因则与多种正常肌肉功能相关的过程有关。
此外,研究者还发现,经SAHA/JQ1处理的KP细胞和HT-1080细胞中,MEF2C和CDKN1C的mRNA水平均显著增加。然而,MYOD1的mRNA水平并未受到影响。由于MYOD1在蛋白质水平上的调节是通过与p57的物理相互作用来实现的,研究者进一步通过蛋白质印迹技术测试了小鼠和人UPS细胞中Myod和p57的表达情况,并发现这两种蛋白质在药物处理的细胞中均有所增加。值得注意的是,YAP1及其转录靶点FOXM1的表达在药物处理后几乎被完全抑制。在HT-1080细胞中,研究者也观察到了类似的效果。
综上所述,这些研究结果表明,SAHA/JQ1联合治疗能够促进肉瘤细胞的分化,这可能是由于它抑制了YAP1介导的转录调节所致。因此,SAHA/JQ1通过诱导肌肉分化来减少肉瘤的形成,为肉瘤的治疗提供了新的潜在策略。
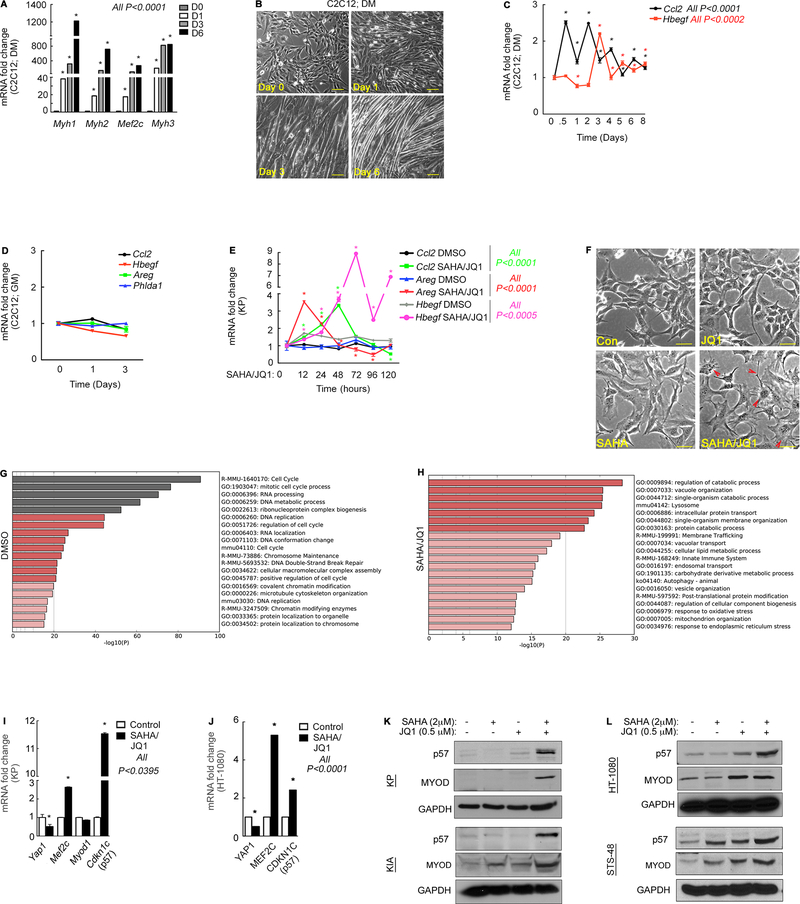
为了深入理解Usp31表达的功能后果,研究者采用了特定的shRNA技术来沉默Usp31。结果显示,当Usp31的表达降低50%时,KP细胞的体外增殖能力显著增加,这与NFκB活性增强的观察结果相一致。此外,在荧光素酶报告系统中,Usp31 shRNA的表达能够逆转SAHA/JQ1对NFκB活性的抑制作用。这一发现清晰地揭示了Usp31在介导SAHA/JQ1对NFκB活性影响中的关键作用。
为了进一步证实药物治疗通过上调Usp31来抑制NFκB信号传导的假设,研究者关注了早期NFκB调节剂Traf2,它是Usp31肽酶活性的直接靶标。研究结果显示,Traf2的K63连锁泛素化依赖于Usp31。有趣的是,在SAHA/JQ1处理的细胞中,Traf2的蛋白表达水平下降,而微阵列分析显示,与Yap1及其转录靶点Foxm1和Birc5相比,Traf2的mRNA水平并未发生显著变化。这些数据表明,Usp31介导的K63连接的泛素化影响了Traf2蛋白的稳定性。
为了验证Yap1对增殖的影响主要归因于其对Usp31表达的控制,研究者进行了体内拯救同种异体移植试验。通过蛋白质印迹分析和qRT-PCR表达检测,研究者确认了细胞中Yap1和Usp31表达的抑制情况。与之前的研究报道一致,与Scr shRNA对照相比,Yap1 shRNA的表达显著降低了肿瘤的生长和重量。与研究者在体外增殖试验中的发现相符,Usp31特异性shRNA增加了肿瘤的生长。最重要的是,Usp31表达的缺失能够逆转Yap1 shRNA介导的肿瘤生长减少。因此,研究者得出结论,Usp31的抑制对于YAP1依赖性肿瘤的发生至关重要。
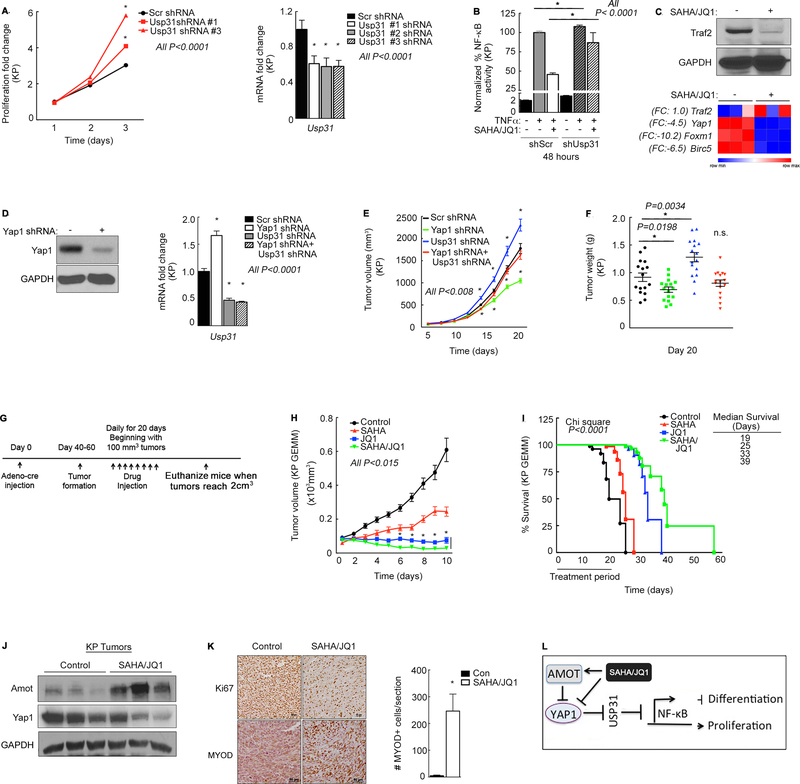
研究者的主要目标之一是探索治疗未分化多形性肉瘤(UPS)和其他肉瘤的新方法。为了测试SAHA/JQ1作为治疗策略的潜在效果,研究者评估了药物组合在体内对KP基因工程小鼠模型(GEMM)肿瘤的影响。结果显示,SAHA/JQ1治疗在模型中引起了统计学上显著的肿瘤消退,并且联合治疗将肿瘤达到最大体积的时间延迟了2倍。SAHA和JQ1的组合治疗最为有效,中位生存期达到了39天。此外,与对照相比,SAHA/JQ1处理的KP肿瘤组织中的Amot水平显著升高,这与研究者在体外研究中的发现相一致。SAHA/JQ1治疗的KP肿瘤的后续免疫组化(IHC)分析显示Myod水平升高,而Ki67阳性细胞在体内减少。这些结果表明,Hippo通路的表观遗传调节可以恢复正常的NFκB活性,从而减少肉瘤的发生,并通过Usp31增加体内的肌肉分化。
综上所述,这些研究结果不仅揭示了Usp31在YAP1依赖性肿瘤发生中的关键作用,还为治疗UPS和其他肉瘤提供了新的潜在策略。SAHA/JQ1组合治疗在体内显示出了显著的抗肿瘤效果,为肉瘤的临床治疗提供了新的希望。
结论与讨论
综上所述,研究者的工作已经明确地将NFκB——这一正常肌肉发育的关键调节因子——定位为肉瘤形成过程中持续上调的重要途径。这一上调过程部分归因于YAP1靶标USP31的异常抑制。具体而言,研究者的数据揭示了几个关键点:YAP1的稳定化、p65的磷酸化以及AMOT的抑制,这些可能作为未分化多形性肉瘤(UPS)的有用生物标志物。此外,这些数据还为表观遗传疗法提供了机械原理,即通过恢复Hippo通路活性到正常水平来治疗该疾病。
NFκB在正常肌肉发育中起着至关重要的作用,而在肉瘤中,其异常激活可能与肿瘤的恶性进展密切相关。研究者发现,在肉瘤形成过程中,NFκB途径的持续上调与YAP1靶标USP31的异常抑制有关。这一发现不仅揭示了肉瘤发生的一个新机制,也为开发新的治疗策略提供了潜在靶点。
YAP1的稳定化是肉瘤发生过程中的一个关键事件。研究者观察到,在肉瘤细胞中,YAP1的表达和稳定性异常增加,这可能与USP31的抑制有关。由于USP31是一种去泛素化酶,其抑制可能导致YAP1的泛素化水平降低,从而增加其稳定性。这种稳定性增加可能进一步促进肉瘤细胞的增殖和恶性转化。
此外,p65的磷酸化也是肉瘤发生中的一个重要事件。p65是NFκB途径的一个关键组成部分,其磷酸化状态可以影响NFκB的转录活性。研究者发现,在肉瘤细胞中,p65的磷酸化水平异常增加,这可能与NFκB途径的持续激活有关。这种激活可能进一步促进肉瘤细胞的生长和侵袭能力。
AMOT作为Hippo通路的一个关键组件,在维持细胞增殖和分化平衡中起着重要作用。研究者发现,在肉瘤细胞中,AMOT的表达受到抑制,这可能与Hippo通路的异常激活有关。由于Hippo通路在调节细胞增殖和分化中起着关键作用,因此AMOT的抑制可能进一步促进肉瘤的发生和发展。
基于这些发现,研究者提出了一个表观遗传疗法的机械原理,即通过恢复Hippo通路活性到正常水平来治疗UPS。具体而言,这种疗法可能通过抑制YAP1的稳定化、降低p65的磷酸化水平以及恢复AMOT的表达来实现。这些措施可能有助于抑制肉瘤细胞的增殖和恶性转化,从而达到治疗疾病的目的。总之,研究者的工作为肉瘤的发生和发展提供了新的见解,并为开发新的治疗策略提供了潜在靶点。未来的研究将进一步探索这些生物标志物和表观遗传疗法在肉瘤治疗中的具体应用和效果。
| 名称 | 货号 | 规格 |
| YAP (D8H1X) XP ® Rabbit mAb | 14074T | 20ul |
| Phospho-YAP (Ser127) (D9W2I) Rabbit mAb | 13008T | 20μl |
| Rabbit anti-Phospho-YAP(Ser127) Polyclonal Antibody | abs130953-50ug | 50ug |
| YAP (G-6) | sc-376830 | 200μg/ml |




































