上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
细胞转染效果好,核转tips少不了
394 人阅读发布时间:2022-05-18 11:58
细胞转染目前有很多种方法,为了选择适合自己实验的方法就要了解清楚每种方法的优劣之处,来看一下各方法比对图吧。

但是理想的细胞转染方法应该具有转染效率高、成活率高,重复率高及操作简单等优点。今天小优给大家安利一下Lonza公司的Nucleofector™技术,一种改进的电穿孔技术,采用细胞特异性溶液,提高转染效率的同时保证成活率。
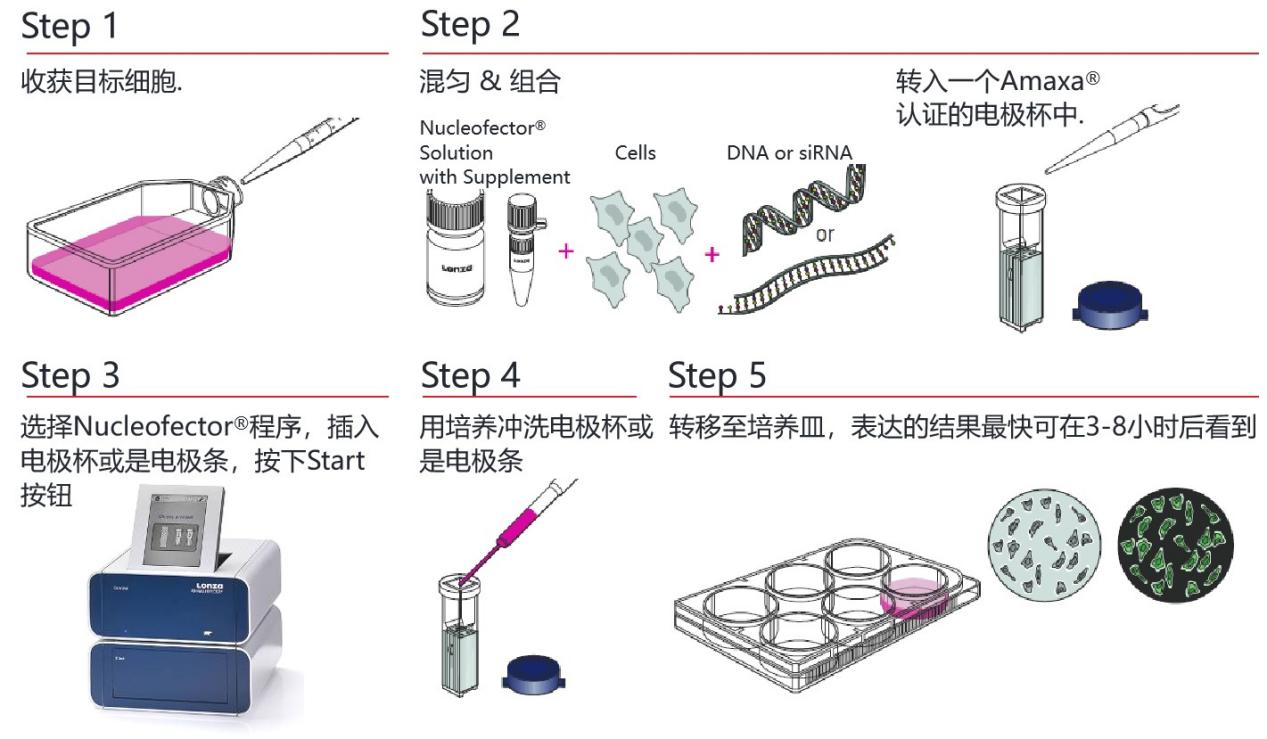
Nucleofector转染实验流程
Nucleofector转染实验流程是非常简单的,但要得到一个比较理想的实验结果还是需要注意一些细节问题的,比如细胞状态,实验操作过程,底物的形式、质量及比例,电转条件和电转后的操作步骤......
Don't Worry, 小优已经给您整理好了转染实验需要注意的事项,实验之前先学习一下,做起核转实验来妥妥的!
转染前:
1. 预先将培养平板与培养基在37度预热。
2. 细胞:注意传代数、汇合度或细胞密度、培养基以及胰蛋白酶处理等,保持较高的细胞活性。如果是新分离的细胞可以直接转,冻存的细胞37度培养1-2h后再转。不要高速离心,不同细胞离心速度及时间不一样,可按照说明书操作。比如PBMC细胞200g,神经元细胞80g等。
3. 底物:使用高纯度,无内毒素的底物,DNA的OD需要大于1.8。底物稀释时需注意最终加入底物的体积不得大于整个体系的10%。
4. 确保转染溶液与添加剂的混合比例为4.5:1。
5. 不需要冰!所有操作都在室温或是37度下进行。
转染时:
1. 细胞计数后按照说明书取适量的细胞,离心后尽可能去除细胞沉淀中的培养基,再用核转专用试剂重悬细胞沉淀。
2.加入适量的底物。不要将细胞留在转染液中太久时间(如15min内)会降低转染效率和成活率。
3. 混合液避免产生气泡,以防影响电转结果。
4. 注意电极杯/条的放置方向。
5. 选择合适的电转程序。
已优化好的细胞类型可按照Protocol操作;没有验证的细胞类型可参考文献或咨询小优推荐合适的程序进行优化。
转染后:
1. 取出电极杯/条后,缓慢加入预热的培养基(也可静置10min后再加入预热培养基),轻柔混匀后转移到培养板中。
2. 电转后的细胞很脆弱,必须轻柔处理。
3. 有些细胞4-8h即可检测到结果,有些需要24或者48h。
4. 根据细胞状态进行换液。正常状态下转染后6h可换液,如果观察到细胞碎片较多,可先换50%液。
5. 继续培养或传代后安排下游实验。
相关产品
| 货号 | 产品名称 | 备注 |
| AAF-1002B | 4D-Nucleofector™ Core Unit | 4D核心元件 |
| AAF-1002X | 4D-Nucleofector™ X Unit | 4D X模块,适用悬浮细胞 |
| AAF-1002Y | 4D-Nucleofector™ Y Unit | 4D Y模块,适用贴壁细胞 |
| V4XP-3024 | P3 Primary Cell 4D X Kit L | 原代细胞如人T细胞,4D平台 |
| V4XC-2024 | SF Cell Line 4D X Kit L | 难转染细胞系如K-562,4D平台 |
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!