上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
AI驱动药物研发:引领医药创新新时代
123 人阅读发布时间:2025-09-11 13:56
AI驱动药物研发:引领医药创新新时代
在生物医药领域,药物研发始终是一场漫长而艰难的征程。传统药物研发模式长期以来面临着高成本、长周期和低成功率的困境,这使得整个行业亟需突破性的创新。而随着人工智能(AI)技术的崛起,这一领域迎来了新的曙光。AI的引入不仅为药物研发提供了全新的思路,还从根本上改变了这一领域的运作方式。今天,我们深入解读发表于《Biomarker Research》期刊上的文章“Integrating artificial intelligence in drug discovery and early drug development: a transformative approach”,探讨AI如何重塑药物研发的格局,为这一传统领域注入变革的力量。

《Biomarker Research》是一本专注于生物标志物研究的学术期刊,致力于发表与生物标志物相关的高质量研究成果,内容涵盖从基础研究到临床应用的多个领域,是生物医药领域内具有重要影响力的学术平台。近期发表于该期刊的文章“Integrating artificial intelligence in drug discovery and early drug development: a transformative approach”由 Alberto Ocana 等人撰写,深入探讨了人工智能(AI)技术在药物发现和早期药物开发中的应用及其变革性潜力。
传统药物研发的困境
传统药物研发,尤其是癌症药物的研发,长期以来面临漫长而复杂的过程。研发周期通常从治疗靶点的识别或具有抗增殖活性化学实体的筛选开始,后续需要进行大量的临床前研究,包括靶点验证、药物作用机制解析以及联合用药策略的探索等。这些环节不仅耗时漫长,而且成本高昂,成功率较低,导致整个研发过程效率低下。尤其是在靶点发现和化合物优化阶段,传统方法往往依赖于大规模的实验筛选和经验性决策,难以快速响应复杂的生物学问题。这种低效的研发模式已成为制约生物医药行业发展的关键瓶颈。
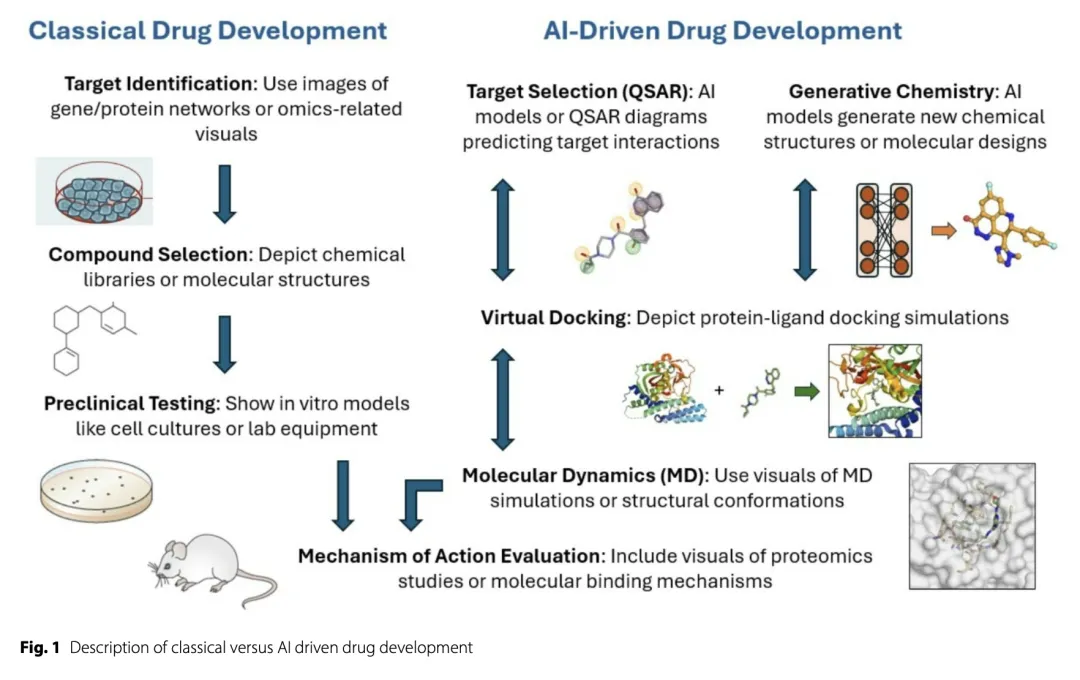
在生物医药领域,药物研发始终是一场漫长而艰难的征程。以癌症药物研发为例,传统模式从靶点识别到临床试验的整个过程往往耗时十年以上,且成功率不足10%。以I期临床试验为例,经典的"3+3"剂量递增设计虽沿用多年,但存在显著局限性:
-
试验效率低下:依赖线性递增的剂量探索方式,单次试验可能耗时数月甚至数年;
-
个体化缺失:忽视患者基因背景、代谢差异等关键变量,导致剂量选择缺乏精准性;
-
数据盲区:过度聚焦急性毒性,对慢性毒性、耐受性及长期安全性数据收集不足,为后续开发埋下隐患。
更深层次的挑战源于癌症生物学的复杂性。肿瘤微环境涉及数百条交织的信号通路,传统"单靶点-单药物"研发范式难以应对这种系统性复杂性。尤其对于蛋白质-蛋白质相互作用(PPI)靶点及"不可成药"靶点(如RAS、MYC),传统方法在分子设计上几乎无从下手,导致药物研发成功率长期停滞在个位数。
AI赋能药物研发的多维突破
1. 靶点识别:从数据迷雾中精准定位
AI技术正在彻底重塑靶点发现的逻辑链条:
-
多组学融合分析:通过深度学习算法整合GWAS、单细胞转录组、蛋白质互作网络等多维数据,精准定位疾病关键节点。例如,Graph Neural Networks(GNNs)可识别传统方法忽略的低丰度基因调控环路;
-
网络药理学应用:基于知识图谱的推理模型(如Transformer架构)能够预测靶点间协同作用,为多靶点药物设计提供理论支撑;
-
空间转录组解析:AI辅助的原位捕获技术可重建肿瘤微环境中的细胞通讯网络,发现隐藏的治疗靶点。
2. 药物发现:超越经验主义的分子设计
AI驱动的药物设计正在打破传统CADD的天花板:
-
虚拟筛选革命:基于深度神经网络的分子指纹编码技术(如Mol2vec)将配体-靶点亲和力预测精度提升至传统方法的3倍以上;
-
从头设计突破:生成式AI(如AlphaFold衍生模型)可针对复杂靶点生成具有全新骨架的药物分子,2022年已有超过20个AI设计分子进入临床试验;
-
物理化学优化:强化学习算法通过模拟分子动力学过程,提前预测候选分子的ADMET性质,将临床前失败率降低40%。
3. 临床开发:重构试验范式的智能引擎
AI正在从根本上重塑临床试验的运行逻辑:
-
患者分层4.0:通过整合多模态生物标志物(影像组学+液体活检),AI可实现亚型分层精度提升2-3个数量级;
-
自适应设计进化:Bayesian优化算法支持实时调整剂量爬坡策略,使I期试验周期缩短60%;
-
数字孪生试验:基于联邦学习的患者数字模型可在虚拟环境中完成90%的剂量探索工作,显著降低伦理风险。
AI应用的现实挑战与突破路径
1. 数据质量困局
-
偏差放大效应:训练数据的种族/性别偏差会导致AI模型在真实世界中出现系统性误判;
-
动态数据鸿沟:现有数据库缺乏对耐药进化、微环境重塑等动态过程的覆盖;
-
解决思路:构建联邦学习框架下的动态数据联盟,通过差分隐私技术保护数据主权的同时实现知识共享。
2. 监管适配难题
-
黑箱证据困境:监管机构要求的"可解释因果证据"与AI输出的"概率分布预测"存在根本冲突;
-
合规性瓶颈:GDPR等法规对AI生成数据的归属权界定模糊,影响跨国临床试验开展;
-
破局之道:开发符合监管要求的"监管级AI",通过Shapley值分解等方法实现预测结果的因果可溯性。
3. 技术融合挑战
-
多尺度建模难题:从量子化学级别分子相互作用到组织器官级别的系统效应,AI模型面临维度灾难;
-
实时反馈瓶颈:临床数据的滞后性与AI模型迭代需求之间存在时间差;
-
未来方向:构建基于数字孪生的闭环研发系统,实现从虚拟试验到真实世界的无缝衔接。
结语:迈向人机协同的药物研发新范式
AI并非要取代传统药物研发,而是作为"认知增强器"扩展人类科学家的能力边界。未来十年,随着量子计算、类脑芯片等新技术的融入,AI驱动的药物研发将进化为具备自适应学习能力的智能系统。这要求构建跨学科创新生态:药企需要培养既懂药物化学又掌握机器学习的"π型人才";监管机构应建立动态证据标准;学术界需开发可解释AI模型。唯有如此,才能真正将AI潜力转化为患者获益,开启药物研发的智能纪元。



































