上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
两篇文章带你深入了解铁死亡!(下)
3305 人阅读发布时间:2021-06-07 15:19
02
Energy-stress-mediated
AMPK activation inhibits ferroptosis
硒蛋白谷胱甘肽过氧化物酶4(GPX4)是铁死亡的主要调节剂,铁死亡是铁依赖性脂质过氧化诱导的程序性细胞死亡的一种形式。GPX4 将脂质氢过氧化物转化为无毒脂质醇,从而防止了铁锈病。
研究表明,硒可增强 GPX4 表达并抑制铁传染性死亡以保护神经元。另外,某些抗治疗性癌细胞依靠 GPX4 存活。许多癌细胞主要通过胱氨酸、谷氨酸获得半胱氨酸反转运蛋白被称为系统XC−介导的胞外胱氨酸的转运,相应地,胱氨酸耗竭、抑制系统XC−介导的胱氨酸转运或RSL3失活GPX4可诱导铁死亡。
本篇文章主要能量代谢与铁死亡之间展开研究,详细分析了两者之间的联系。
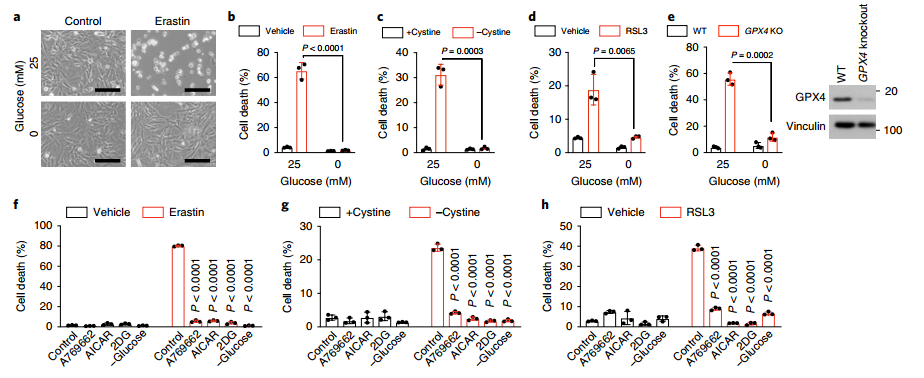

图一:能量胁迫抑制铁死亡
a-b、显微镜下观察发现,无糖培养可以抑制铁死亡诱导剂Erastin诱导的MEFs细胞死亡;
c、无糖培养发现可以抑制胱氨酸缺失诱导的MEFs细胞死亡;
d、无糖培养可以抑制GPX4抑制剂RSL3诱导的MEFs细胞死亡;
e、无糖培养可以抑制诱导GPX4敲除诱导的MEFs细胞死亡;
f-h、AMPK的抑制剂A769662、AICAR和2DG)以及缺糖处理都可以显著抑制erastin、胱氨酸缺失以及RSL3诱导的细胞死亡;
i-k、AMPK抑制剂和缺糖处理都可以显著抑制erastin、胱氨酸缺失以及RSL3诱导的脂质过氧化作用。
以上数据表面,不同的方法分别诱导细胞铁死亡,均发现了无糖培养可以抑制被诱导的细胞铁死亡现象,这说明提示葡萄糖能量胁迫可以抑制MEFs细胞铁死亡,同时也发现了AMPK抑制剂能够发挥与葡萄糖缺失相同的对铁死亡抑制的效果。

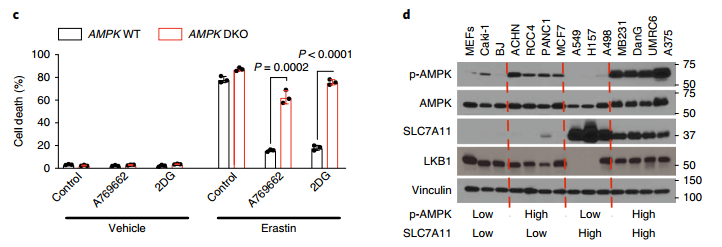
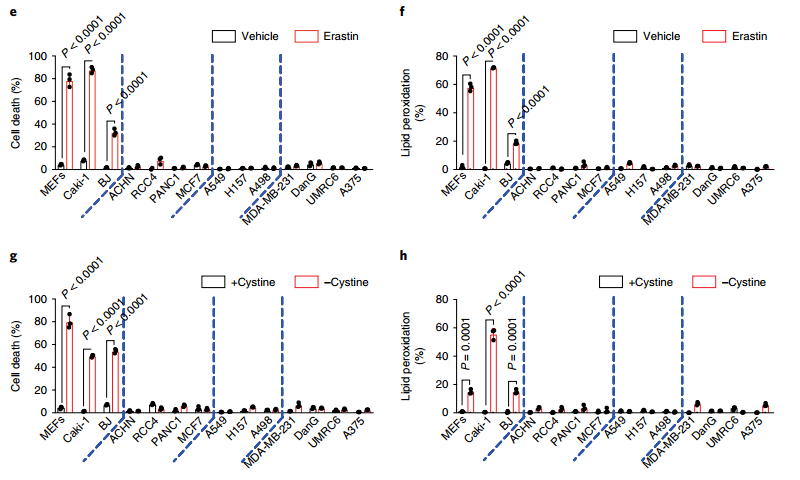
图二:能量胁迫可以通过AMPK抑制铁死亡
a、WB结果显示,AMPK-DKO MEFs细胞中,AMPKα水平显著低于野生型;
b-c、AMPK-DKO几乎完全逆转了A769662、2DG、缺糖诱导的MEFs细胞铁死亡;
d、WB结果表明,14种不同的肿瘤细胞中,发现SLC7A11表达量低的细胞系中,p-AMPK表达量也相对较低;
e-f、Erastin诱导后,SLC7A11和p-AMPK表达量低的细胞系死亡率显著升高;
g-h、胱氨酸缺失处理后,SLC7A11和p-AMPK表达量低的细胞系死亡率显著升高。
这组数据表明p-AMPK的激活与SLC7A11的表达缺失会显著增强铁死亡诱导剂对铁死亡的诱导效果。
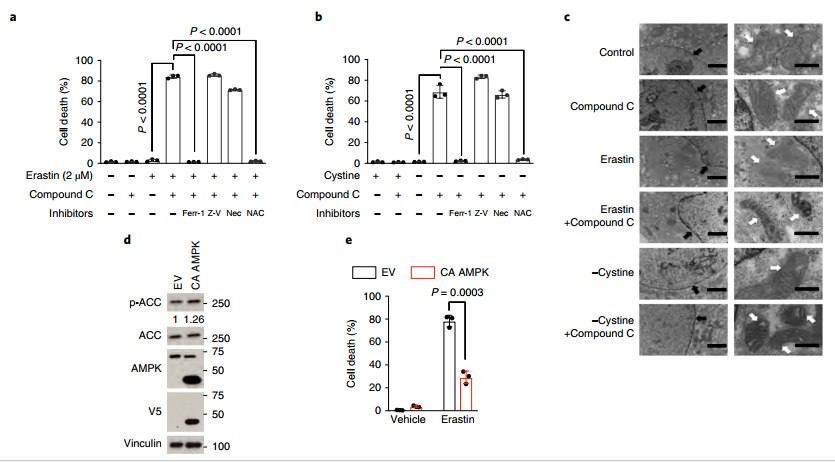

图三:AMPK失活使细胞对铁死亡敏感
a、在p-AMPK高表达的ACHN细胞中发现,用erastin和AMPK抑制剂compound C同时处理时,细胞死亡率显著升高,但这一现象可以被Ferr-1和ROS抑制剂NAV逆转,但不能被caspase抑制剂Z-V或细胞坏死抑制剂Nec逆转;
b、用Cystine和compound C同时处理ACHN细胞时,细胞死亡率显著升高,且可以被Ferr-1、NAV抑制,但不能被Z-V、Nec抑制;
c、电镜结果显示compound C和Erastin处理的ACHN细胞表现出线粒体萎缩,膜密度增加,细胞核内没有明显的DNA断裂,表现出明显的铁死亡特征;
d-e、在p-AMPK低表达的Caki-1细胞中过表达AMPK,使AMPK与p-ACC表达量升高,结果抑制了erastin诱导的铁死亡;
f-k、ACHN细胞Cas9进行AMPKα1/α2 DKO处理后,明显增加了对erastin/Cystine缺失诱导铁死亡/脂质过氧化作用的敏感性;
l-m、在AMPKα1重新表达的ACHN细胞中,AMPK、p-ACC的表达量明显升高,且相比AMPK突变体T172A、AMPKα2,AMPKα1的重新表达更能够抑制Cystine缺失诱导的ACHN细胞铁死亡;
f-m、在缺失AMPKα1的细胞中再次恢复它的表达,结果表明AMPK对铁死亡有调控作用。
以上数据表明,p-AMPK的表达量高低,显著影响了细胞对铁死亡(不是凋亡、也不是坏死)诱导的敏感度。AMPK失活后,使细胞对铁死亡更加敏感。
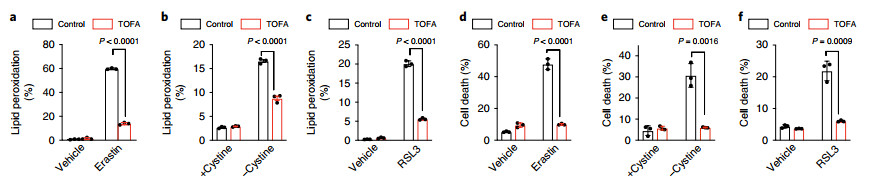
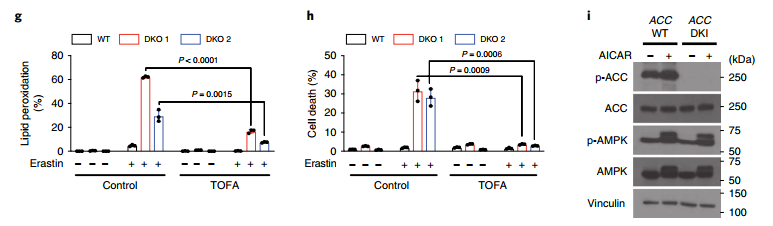

图四:AMPK介导的ACC磷酸化可抑制铁死亡
(a-F).和能量胁迫类似,用TOFA(ACC抑制剂)处理后可以显著的抑制erastin/Cystine缺失/RSL3诱导的MEFs细胞系铁死亡,和脂质过氧化作用。
(g-h).TOFA处理后,AMPKα1/α2 DKO导致的ACH细胞脂质过氧化作用/铁死亡明显缓解。
(i).ACC double knock-in (DKI)小鼠来源MEFs,其中ACC1 (S79)和ACC2 (S212)上的AMPK磷酸化位点均突变为丙氨酸。
(j-l).类似AMPK DKO,AMPK磷酸化位点突变后可缓解A769662/AICAR/能量胁迫处理后由Erastin导致的铁死亡抑制。
以上fig4说明,AMPK介导ACC磷酸化,对铁死亡有抑制作用。


图五:AMPK调节PUFA在细胞内的脂质积聚
a、在经过可逆的AMPK激活剂A769662处理MEFs细胞中发现,64种脂类水平显著降低;
b、AMPK DKO ACHN细胞与WT ACHN细胞相比,73种脂质相对丰度显著增加;
c、结合a和b的分析发现了17种脂类在A769662(AMPK激活剂)处理MEFs中下调,而在ACHN AMPK缺失细胞中上调;
d-e、二高γ亚麻酸、PUFA在A769662处理的MEFs细胞中下调,但在ACHN AMPK缺失细胞中上调;
f-g、二高γ亚麻酸前体、花生四烯酸可以使经过A769662处理的MEFs/AMPK ACHN细胞对erastin诱导的铁死亡更敏感。
以上一组数据说明, AMPK的表达高低可以显著调节花生四烯酸在细胞内的积聚,从而影响细胞对铁死亡的敏感度。


图六:AMPK的活化可保护IRI的肾脏损伤
a、实验结果显示,胰岛素IRI高的小鼠,肾上皮细胞出现明显的铁死亡相关形态学改变,如线粒体变圆,嵴加深等形态特征;
b、WB结果表明,AICAR或2DG治疗显著增加了肾脏中AMPK的磷酸化水平;
c-d、HE染色结果显示,AICAR或2DG治疗和fer-1一样,对IRI肾脏组织损伤有一定的保护作用;
e-g、在AMPK DKO的小鼠中,AICAR对IRI肾损害和血尿素氮水平的保护作用大部分被消除;
h-i、免疫组化结果显示,在AMPK DKO的小鼠中,IRI WT中的4-HNE降低,IRI+AICAR中4-HNE的水平又有上升。
这组实验结果表明AMPK活化可对肾细胞的铁死亡产生抑制,进而保护IRI的肾脏损伤。
本篇文章用到的部分相关抗体整理如下:

文章分析完了,接下来让我们一起了解下目前检测铁死亡的方法吧。
1、检测相关指标的相关活性:
①可以通过检测细胞活性来判断细胞是否发生了铁死亡:如常用的检测方法CCK-8和MTT;
②可以检测细胞内铁水平来分析细胞铁死亡的情况:使用PGSK探针检测,通过流式细胞术或共聚焦显微镜监测活细胞内铁含量的细胞膜透性染料,在铁死亡的细胞中,PGSK的绿色荧光会减弱;或者使用Iron Assay Kit检测细胞、组织中的铁水平。
③可以判断细胞内活性氧的水平来检测细胞的铁死亡:细胞内活性氧和脂质活性氧通过流式的方法,检测DCFH-DA(表达上调)或C11-BODIPY荧光探针,在铁死亡细胞中,DCFH-DA会表达上调,C11-BODIPY荧光探针会由红色转化为绿色。
④通过常用的qPCR/WB方法对铁死亡进行检测:检测细胞内与铁死亡相关因子的变化,如COX-2,ACSL4,PTGS2,NOX1,GPX4和FTH1等,其中COX-2,ACSL4,PTGS2和NOX1在铁死亡的细胞中表达上调,GPX4和FTH1在铁死亡的细胞中表达下调。
2、观察细胞的形态特征:
①透射电镜直接对细胞形态进行观察:细胞发生铁死亡时线粒体变小以及线粒体膜密度较大。
②对线粒体膜电位进行检测:通过流式的方法收集TMRE阳性细胞的比例来判断细胞是否发生铁死亡。
③观察线粒体的形态变化:向细胞内转染LifeAct-GFP荧光蛋白,一定时间后通过有丝分裂追踪器观察线粒体的形态是否发生相关的变化。
检测铁死亡的相关产品: