上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
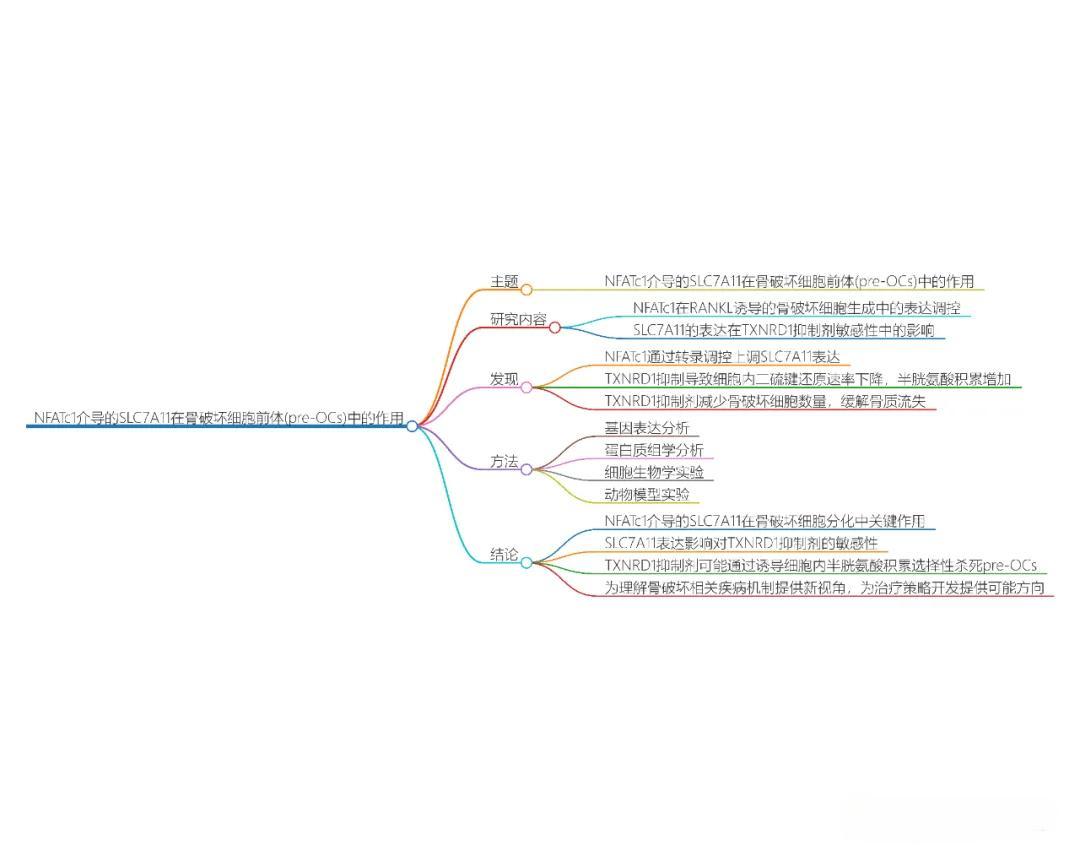
文献解析 | SLC7A11:调节细胞氨基酸转运与肿瘤耐药性的关键分子
352 人阅读发布时间:2025-02-11 15:11
本论文深入探讨了NFATc1在骨破坏细胞前体(pre-OCs)中调控SLC7A11表达的作用机制,并分析了这种调控如何影响细胞对TXNRD1抑制剂的敏感性。研究揭示,在RANKL诱导的骨破坏细胞生成过程中,NFATc1作为转录因子显著上调SLC7A11的表达。进一步地,TXNRD1抑制导致细胞内二硫键还原速率骤降,半胱氨酸累积增多,从而触发了二硫键应激与细胞死亡。值得注意的是,TXNRD1抑制剂在骨囊肿模型中有效增加了半胱氨酸水平,减少了破骨细胞数量,并在去卵巢小鼠模型中展现出缓解骨质流失的潜力。

方法
本研究综合运用了基因表达谱分析、蛋白质组学技术、细胞培养与功能实验以及动物模型验证等多种手段。首先,通过基因与蛋白质组学鉴定了NFATc1与SLC7A11在RANKL诱导下的表达变化。随后,细胞实验揭示了NFATc1介导的SLC7A11表达对TXNRD1抑制剂敏感性的调控机制。最终,动物实验验证了TXNRD1抑制剂在骨囊肿模型中对半胱氨酸含量、破骨细胞数量及骨质流失的影响。
结论
本研究得出结论,NFATc1调控的SLC7A11表达在骨破坏细胞分化中扮演核心角色,并显著影响细胞对TXNRD1抑制剂的敏感性。此外,TXNRD1抑制剂通过诱导半胱氨酸积累和二硫键形成,展现出对pre-OCs的选择性杀伤作用。这些发现不仅为理解骨破坏相关疾病的病理机制提供了新视角,也为开发针对性治疗策略开辟了新途径。
图示与数据解析
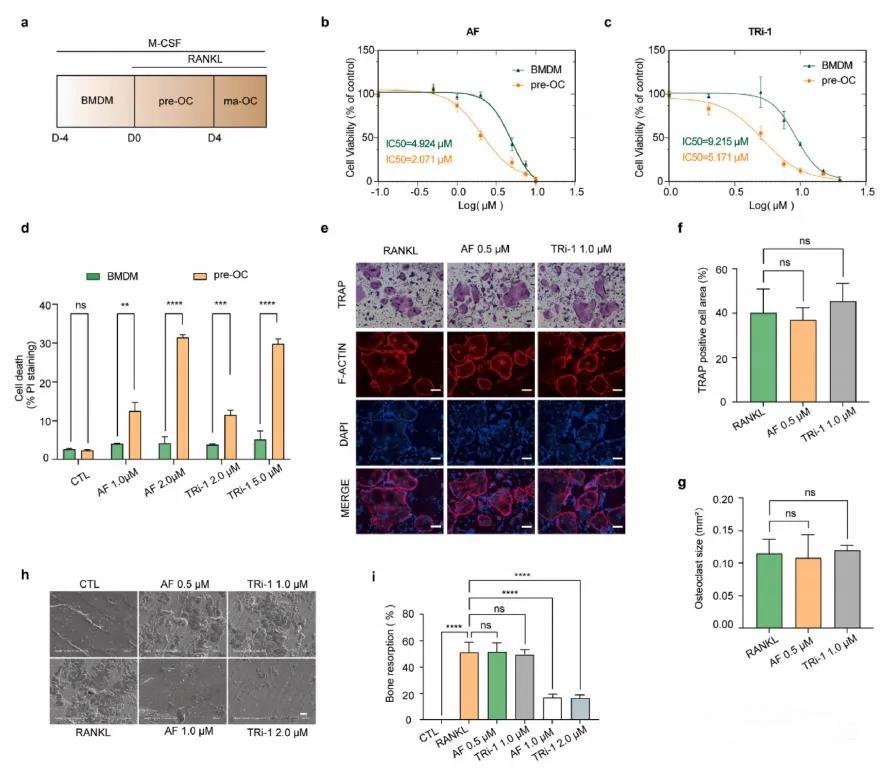
本图系列展示了BMDMs与pre-OCs对TXNRD1抑制剂敏感性的评估。通过体外分化模型(a部分),结合细胞活力(b-c部分)、PI染色(d部分)及TRAP染色与F-actin形成实验(e-g部分),验证了TXNRD1抑制剂对pre-OCs的特异性影响。骨吸收实验(h-i部分)进一步确认了抑制剂在减少骨吸收方面的作用。
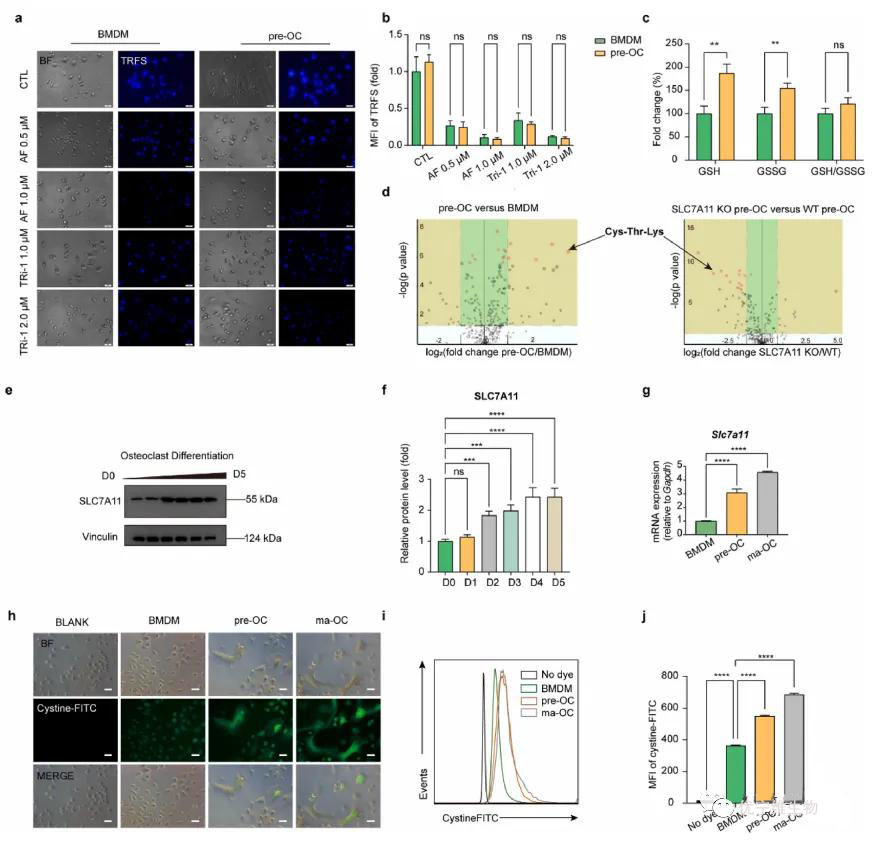
该图示阐述了SLC7A11介导的半胱氨酸摄取及其在pre-OCs中二硫键代谢应激中的作用。TRFS探针检测(a-b部分)与代谢组学分析(d部分)揭示了pre-OCs中独特的代谢特征。SLC7A11蛋白与基因表达水平的变化(e-g部分)及其介导的半胱氨酸摄取能力(h-j部分)进一步支持了其在二硫键应激中的角色。
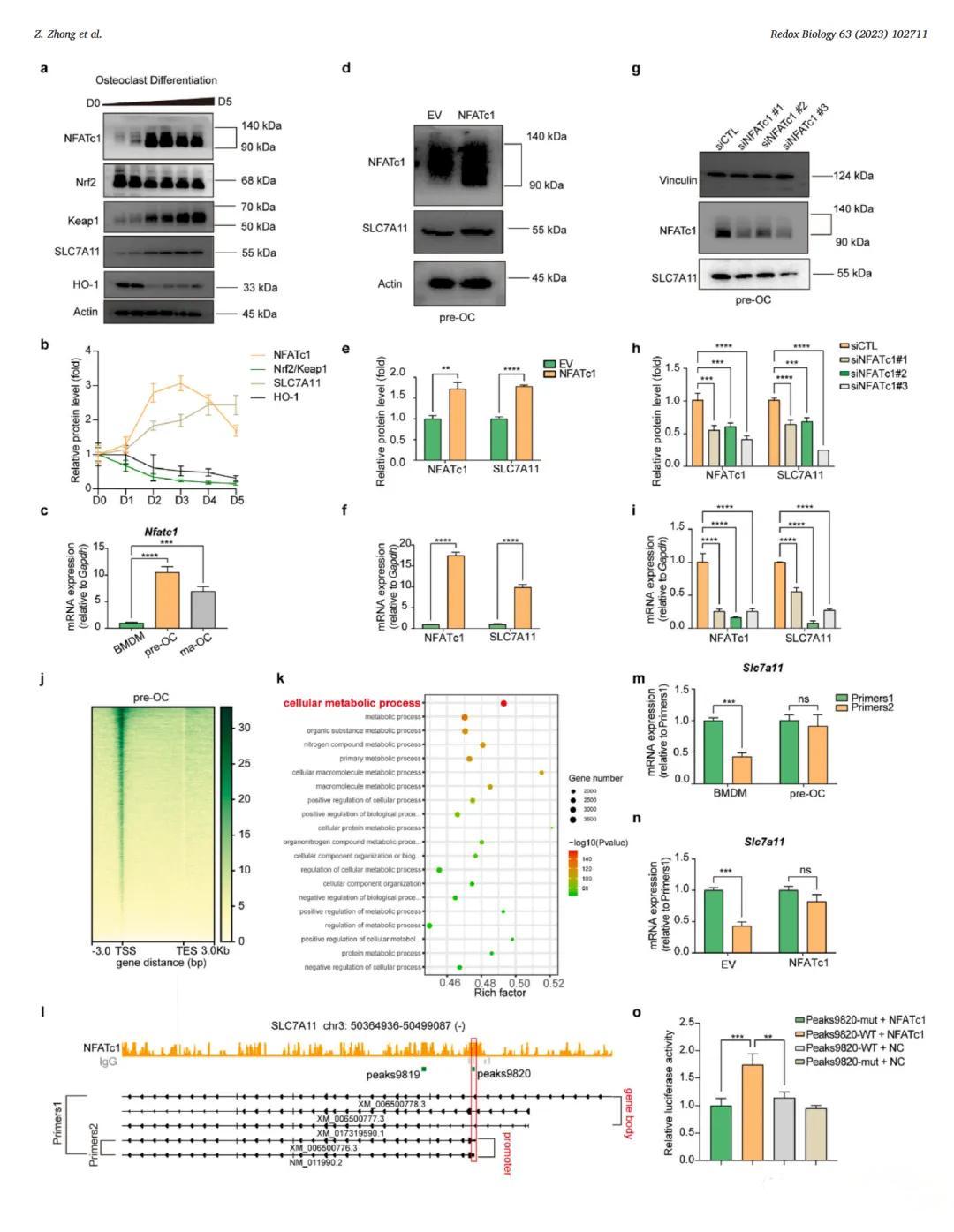
本图展示了NFATc1在成骨细胞分化过程中对SLC7A11转录的促进作用。通过过表达与敲低实验(结合CUT&Tag测序与荧光素酶报告基因实验),确认了NFATc1与SLC7A11之间的直接调控关系,并揭示了其在TXNRD1抑制剂敏感性中的关键作用。
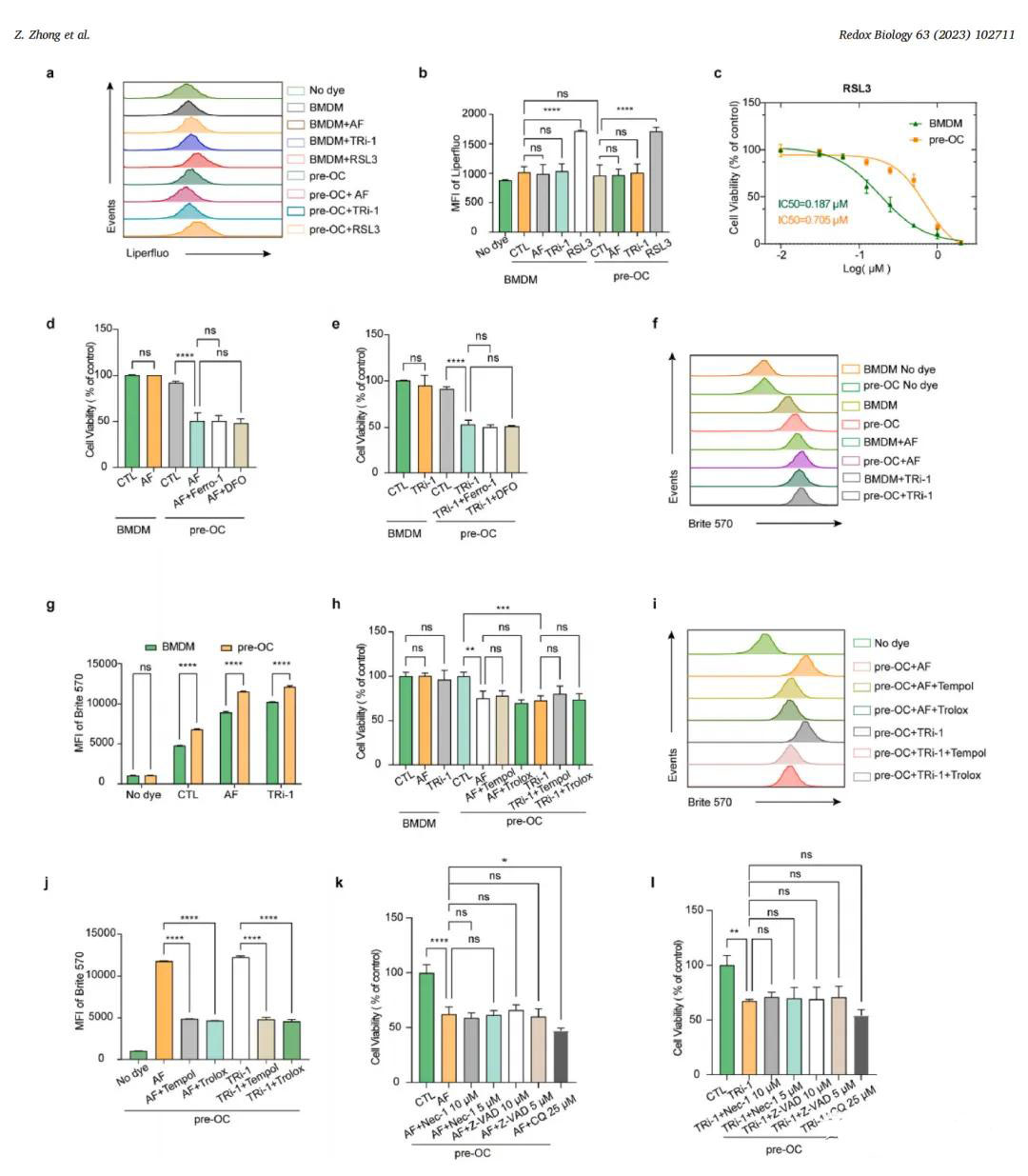
该图示聚焦于TXNRD1抑制剂在pre-OCs中诱导的细胞死亡类型。通过脂质过氧化评估(a-b部分)、铁死亡与ROS清除实验(c-j部分)及凋亡、坏死样凋亡与自噬抑制剂测试(k-l部分),排除了其他死亡途径,强调了二硫键应激在细胞死亡中的核心作用。
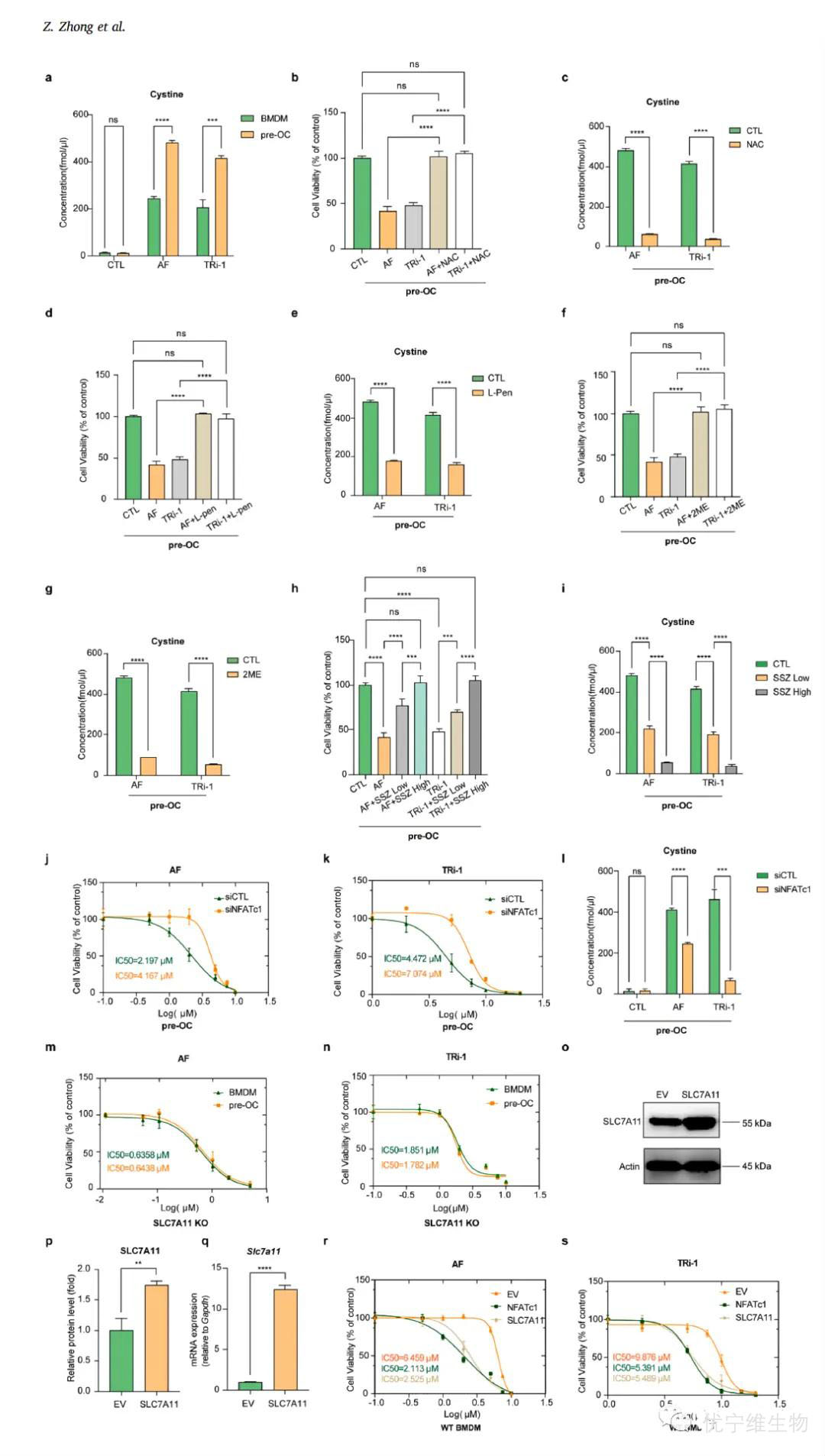
本图系列验证了防止二硫键积累或SLC7A11抑制剂在拯救TXNRD1诱导细胞死亡中的有效性。HPLC-MS/MS分析(a-c部分)与药物相互作用检测(d-e部分)结合细胞实验(f-h部分),揭示了半胱氨酸积累与细胞死亡之间的直接联系。NFATc1与SLC7A11敲低及过表达实验(i-n部分)进一步确认了其调控机制。
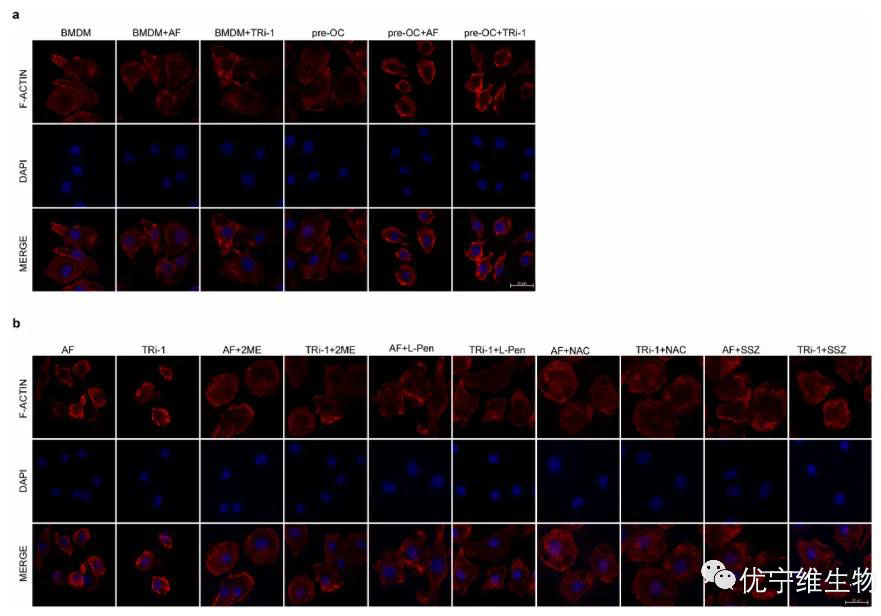
该图示通过F-actin染色展示了TXNRD1抑制剂诱导的细胞骨架变化及其恢复过程,强调了二硫键积累在细胞形态变化中的关键作用。
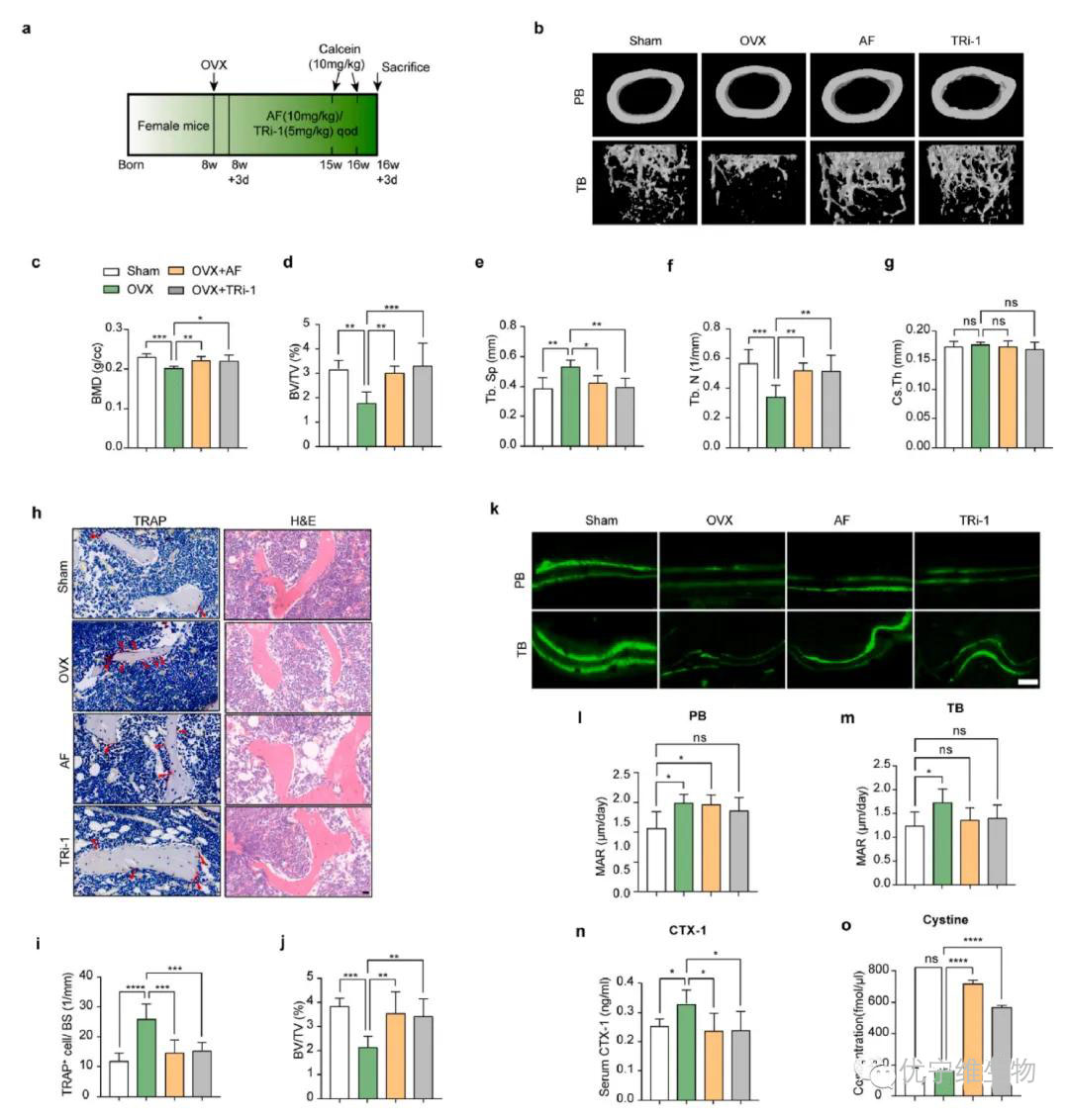
本图展示了TXNRD1抑制剂在小鼠股骨中的治疗效果,包括半胱氨酸含量增加、TRAP阳性细胞减少及骨质流失缓解等,验证了其在体内模型中的有效性。
文章特色
特异性敏感性:pre-OCs相较于BMDMs对TXNRD1抑制剂展现出更高的敏感性,这归因于NFATc1介导的SLC7A11表达上调。
死亡机制新发现:SLC7A11抑制剂与防止二硫键积累的方法能有效拯救TXNRD1诱导的细胞死亡,而传统抑制剂如铁死亡抑制剂与ROS清除剂等则无效。
治疗潜力:TXNRD1抑制剂通过增加半胱氨酸含量与减少破骨细胞数量,在缓解骨质流失方面展现出巨大潜力。
选择性杀伤机制:TXNRD1抑制剂通过诱导半胱氨酸积累与二硫键形成,实现了对pre-OCs的选择性杀伤。
多通路调控:TXNRD1抑制剂通过NFATc1-SLC7A11轴、半胱氨酸积累与二硫键形成等多条信号通路,共同抑制破骨细胞生成。
| 名称 | 货号 | 规格 |
| xCT/SLC7A11 (D2M7A) Rabbit mAb | 12691S | 100ul |
| SLC7A11 | 394590 | 200ul |
| Human xCT/SLC7A11 MAb (Clone 1057408) | MAB11251-SP | 25ug |



































