上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|乳酸盐-乳酸化途径与HSPA6轴协同抑制IFN-β生成,加速PRRSV复制
315 人阅读发布时间:2025-02-18 15:06
Tom20
介绍一篇于2024年1月在《Journal of Virology》上发表的文章,标题为“乳酸-乳酸化-HSPA6轴通过阻碍IFN-β产生促进PRRSV复制”。这项研究揭示了一个新发现:活化的乳酸-乳酸化-HSPA6轴能够抑制干扰素β(IFN-β)的诱导,从而为猪繁殖与呼吸综合征病毒(PRRSV)的生长提供助力。此研究成果不仅为预防和控制PRRSV感染开辟了新的治疗策略,还首次将乳酸化与病毒的生命周期联系起来,深化了我们对病毒感染过程中表观遗传调控机制的认识。

研究背景
早在2009年,科学家们就揭示了一种新型的表观遗传修饰——乳酸诱导的乳糖化,它能够直接调控染色质的基因转录活动。自那以后,这种修饰在肿瘤形成、炎症反应以及免疫调节等多个生物过程中均被证实发挥着关键作用。众多病毒感染,包括SARS-CoV-2、IAV、DENV、HBV以及PRRSV等,都被发现能通过激活糖酵解途径来促进乳酸的生成。然而,关于病毒诱导的乳酸是否参与调控宿主的乳酸化过程,以及乳酸化在病毒感染中所扮演的角色,此前一直缺乏相关报道。
PRRSV作为全球养猪业中最为普遍的病原体之一,自1987年被发现以来,已经给该行业带来了巨额的经济损失。尽管市面上已经推出了几种针对PRRSV的商业疫苗,但由于该病毒具有高度的变异性和快速的重组能力,使得传统疫苗难以持续有效地控制其传播。病毒与宿主细胞之间的代谢相互作用是病毒感染和发病机制的核心环节,因此,深入探究PRRSV与宿主细胞代谢之间的相互作用,有望为病毒感染的防控和新型抗病毒药物的开发提供新的视角和策略。
此前的研究已经表明,PRRSV感染能够增强糖酵解过程,从而促进乳酸的产生。然而,PRRSV诱导产生的乳酸所具有的生物学意义,一直以来都是一个未解之谜。在本研究中,作者们取得了突破性进展:他们发现PRRSV诱导产生的乳酸不仅能够促进细胞的乳酸化修饰,还能显著增强病毒的增殖能力。此外,作者们还鉴定出热休克蛋白6(HSPA6)是PRRSV感染后组蛋白乳糖化修饰的一个下游基因,并进一步证明了HSPA6通过抑制干扰素β(IFN-β)的诱导,在PRRSV的生长过程中发挥着至关重要的作用。
研究结果
01 乳酸促进PRRSV增殖
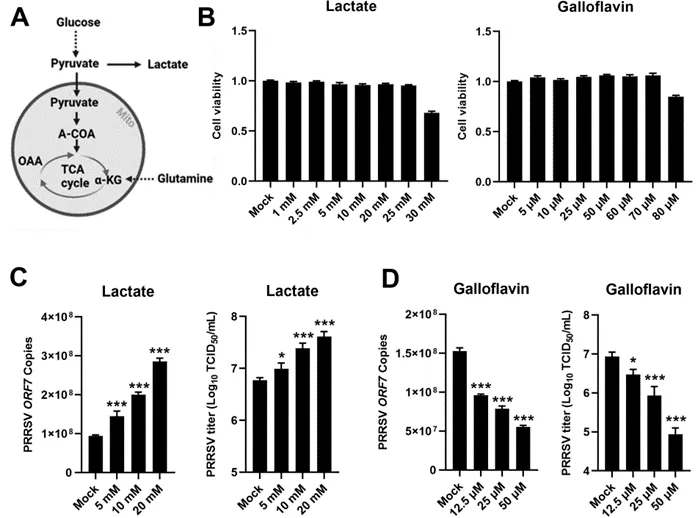
为了深入研究乳酸在PRRSV感染过程中所起的作用,作者首先采用了体外实验方法,选取了对PRRSV具有高度敏感性的猪肺泡巨噬细胞(简称IPAM细胞),并向这些细胞接种了PRRSV。接着,作者将这些接种后的细胞分别置于含有乳酸或乳酸抑制剂(即没食子黄素)的培养环境中进行培养(如图1A所示)。
为了确定在不引起细胞毒性的前提下,乳酸和没食子黄素在IPAM细胞中的适宜工作浓度,作者采用了细胞计数试剂盒-8(CCK-8)进行了细胞活力测定(如图1B所示)。
随后,作者进一步分析了在乳酸或氟乙酸(这里可能是一个笔误,原文中提及的是乳酸和没食子黄素,而氟乙酸并未在前文提及,但根据上下文理解,此处应是指没食子黄素的处理效果)处理后的病毒RNA含量以及病毒滴度。实验结果显示,当用乳酸处理PRRSV感染的细胞时,病毒的RNA拷贝数和滴度均会随着乳酸剂量的增加而呈现上升趋势(如图1C所示)。相反地,当使用无毒浓度的乳酸抑制剂——没食子黄素进行治疗时,病毒的RNA拷贝数和滴度则会随着没食子黄素剂量的增加而显著降低(如图1D所示)。
这些实验结果有力地证明了乳酸在促进PRRSV增殖方面发挥着积极作用。
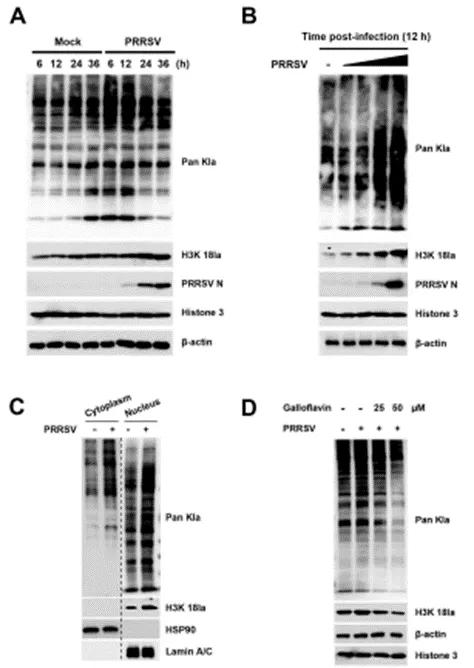
02 PRRSV感染上调细胞乳酸化
鉴于PRRSV感染会提升细胞内乳酸水平,进而促进病毒复制,且乳酸作为乳酸化修饰的底物,作者接下来探究了PRRSV感染是否会导致细胞乳酸化水平上升。为此,他们采用了抗Pan乳酸化(PanKla)抗体,在不同时间点检测了PRRSV感染后细胞的乳酸化动力学变化。结果显示,与未感染的细胞相比,PRRSV感染的细胞内乳酸化水平显著升高(图2A)。这一发现不仅在IPAM细胞(图2B)中得到了验证,在原代猪肺泡巨噬细胞(PAMs,PRRSV在体内的主要靶细胞)以及Marc-145细胞(一种常用于PRRSV分离和疫苗生产的猴肾细胞系)中,PRRSV感染同样以剂量依赖的方式增加了细胞的乳酸化水平,这表明PRRSV诱导的细胞乳酸化并非特定于某一细胞类型。为了进一步确认增强的乳酸化是否由PRRSV诱导产生的乳酸所引发,作者使用了25µM和50µM浓度的没食子黄素来抑制PRRSV诱导的乳酸产生。结果显示,在没食子黄素处理后,PRRSV感染细胞的乳酸化水平受到了抑制,这有力地证明了乳酸化是由PRRSV诱导产生的乳酸所触发的(图2D)。
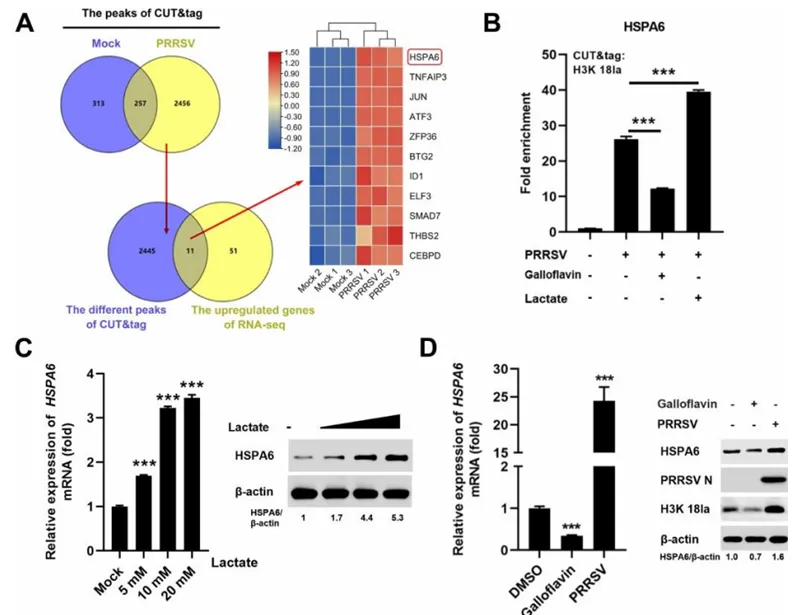
03 PRRSV诱导的组蛋白乳酸化的潜在下游靶点鉴定
为了深入理解组蛋白乳酸化在PRRSV感染细胞内如何调控基因表达,作者首先采用了抗H3K 18la抗体与RNA测序(RNA-seq)相结合的CUT&Tag技术。CUT&Tag数据的维恩图揭示,在未感染的细胞中检测到570个富集峰,而PRRSV感染的细胞中则检测到2769个富集峰(图3A)。值得注意的是,两组间共有257个峰,而PRRSV感染组独有的峰高达2456个(图3A),这些被认为是PRRSV感染可能激活的、具有H3K 18la特异性修饰的基因。随后,通过整合CUT&Tag与RNA-seq数据,作者确定了11个在PRRSV感染细胞中高度表达的抗H3K 18la-CUT&Tag靶基因(图3A)。
为验证CUT&Tag和RNA-seq的结果,作者选取了4个富集基因(HSPA6、TNFAIP3、JUN、ATF3)进行CUT&Tag-qpcr分析。结果显示,与未感染细胞相比,PRRSV感染细胞中这些基因的DNA片段丰度显著增加(图3B)。其中,HSPA6在RNA-seq数据中尤为突出,是PRRSV感染反应中最显著上调的基因(图3A)。进一步分析发现,PRRSV感染细胞经乳酸处理后,HSPA6 DNA片段富集增加;而经乳酸抑制剂没食子黄素处理后,其富集程度降低(图3B)。因此,作者在后续实验中重点关注了HSPA6。
作者接着检测了HSPA6在乳酸、没食子黄素处理或PRRSV感染细胞中的转录和蛋白表达水平。结果显示,乳酸处理或PRRSV感染均能提高HSPA6的mRNA和蛋白水平,而没食子黄素处理则显著降低其表达(图3C和D)。此外,作者还观察了HSPA6在PRRSV感染细胞中的定位情况。与未感染细胞中HSPA6的分散细胞质分布相比,PRRSV感染后HSPA6在整个细胞质中均有分布,表明PRRSV感染改变了HSPA6的分布模式。
为了更精确地确定HSPA6在PRRSV感染细胞中的亚细胞定位,作者使用了一系列抗体对IPAM细胞进行染色,包括兔抗HSPA6抗体以及针对内质网、高尔基体和线粒体的标记抗体。结果显示,无论在PRRSV感染还是未感染的细胞中,HSPA6均与线粒体共定位,而不与高尔基体或内质网共定位。有趣的是,与未感染细胞相比,PRRSV感染细胞的线粒体HSPA6定位信号增强。在未感染细胞中,HSPA6主要定位于线粒体内腔;而在PRRSV感染后,其定位发生变化,主要定位于线粒体管腔壁。综上所述,这些结果表明HSPA6的线粒体定位是H3K 18la修饰的下游效应之一。
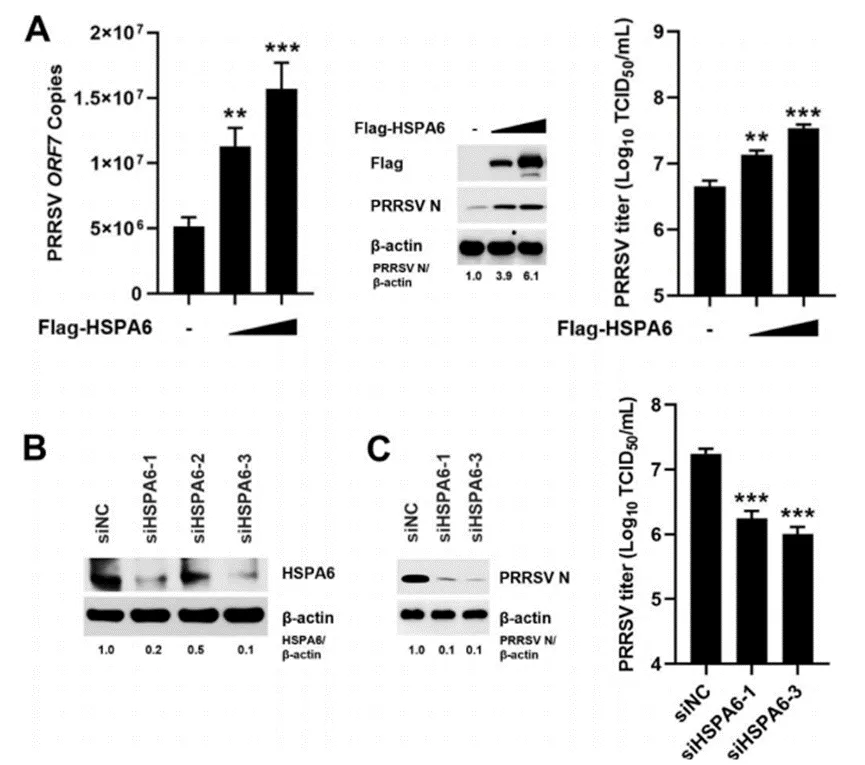
04 HSPA6促进PRRSV增
为了探究HSPA6在PRRSV感染过程中所扮演的角色,作者采取了将HSPA6真核表达构建体导入IPAM细胞,并随后使这些细胞感染PRRSV的策略。实验结果显示,HSPA6的过表达以一种剂量依赖的方式促进了病毒RNA拷贝数的增加、病毒核衣壳(N)蛋白的表达提升以及病毒滴度的上升(图4A)。此外,作者还深入研究了HSPA6基因敲除对PRRSV复制的影响。为此,他们设计了三种专门靶向HSPA6的小干扰RNA(siRNA),并评估了这些siRNA对HSPA6表达的抑制效率。在这些siRNA中,siHSPA6-1和siHSPA6-3展现出了尤为显著的敲低效果(图4B)。随后,作者利用转染了siHSPA6-1或siHSPA6-3的IPAM细胞进行PRRSV感染实验,结果显示,内源性HSPA6的敲低显著降低了病毒的N蛋白水平和病毒滴度(图4C)。综上所述,这些实验结果有力地证明了HSPA6在PRRSV增殖过程中起到了正向调控的作用。
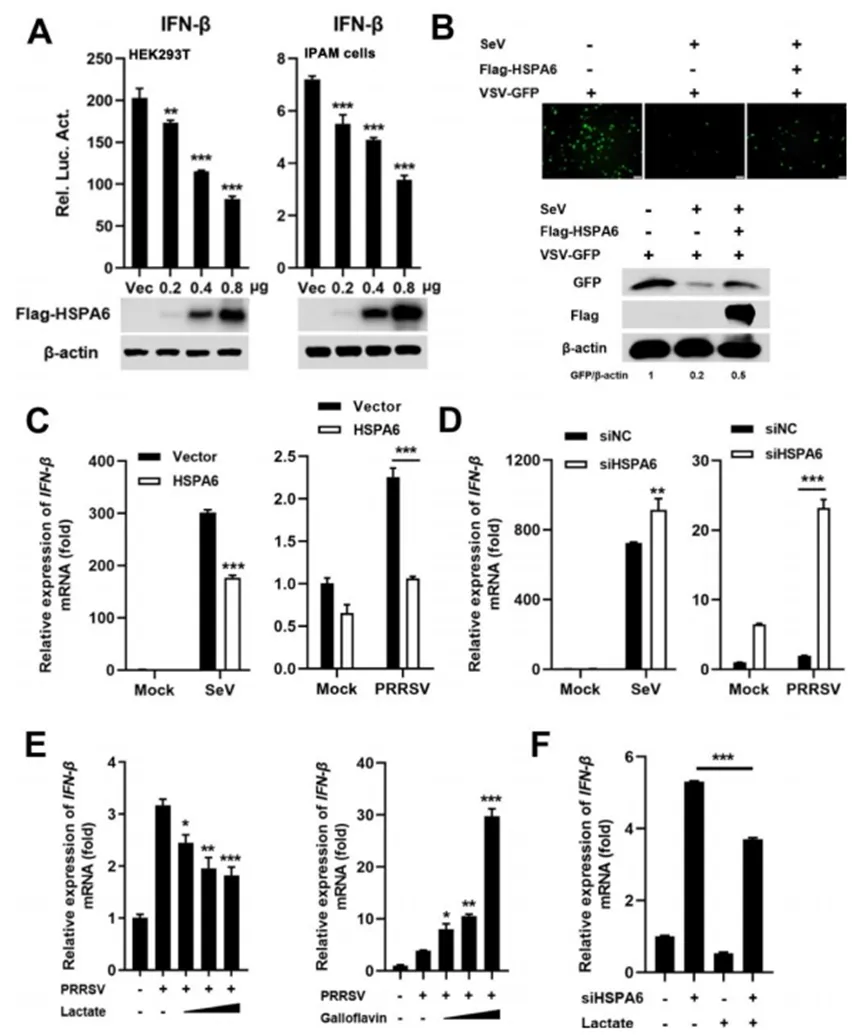
05 HSPA6负调控IFN-β的产生
已知热休克蛋白家族的多个成员,诸如HSP70、HSP27和HSP90,均具备调节干扰素(IFN)产生及其信号传导的功能。鉴于IFN在宿主抵抗病毒感染过程中发挥着核心作用,且PRRSV是一种对IFN敏感的病毒,作者探究了HSPA6是否通过抑制IFN-β的诱导来促进PRRSV的增殖。
为此,作者在HEK293T细胞和IPAM细胞中共同转染了IFN-β-Luc报告质粒、pRLTK质粒以及不同剂量的HSPA6表达构建体或空载体。在转染后24小时,细胞被仙台病毒(SeV)感染或保持未处理状态,随后进行裂解以测定IFN-β启动子驱动的荧光素酶活性。如图5A所示,在两种细胞中,HSPA6的过表达均以剂量依赖的方式显著抑制了SeV诱导的IFN-β启动子激活,提示HSPA6是IFN-β生成的负调控因子。
为进一步验证这一结论,作者采用了稳定表达绿色荧光蛋白的IFN敏感水疱性口炎病毒(VSV-GFP)进行IFN生物测定。结果显示,SeV感染的细胞上清液能够限制VSV-GFP的复制(图5B),但来自过表达HSPA6的细胞的上清液则恢复了VSV-GFP的复制能力(图5B)。此外,实时荧光定量PCR(qRT-PCR)实验表明,HSPA6的过表达显著降低了SeV或PRRSV诱导的内源性IFN-β的转录(图5C),而敲低HSPA6则增强了HEK293T和IPAM细胞中SeV或PRRSV诱导的IFN-β基因转录(图5D)。这些数据均支持HSPA6负调控IFN-β诱导的结论。
已知乳酸诱导的乳酸化可以激活HSPA6(图3),但HSPA6是否以乳酸依赖的方式抑制IFN-β诱导尚不清楚。因此,作者首先研究了乳酸对IFN-β诱导的影响。感染PRRSV的IPAM细胞被乳酸或乳酸抑制剂没食子黄素处理。在孵育24小时后,作者分析了乳酸对PRRSV感染期间IFN-β诱导的影响。结果显示,乳酸以剂量依赖的方式降低了PRRSV感染后IFN-β的mRNA水平(图5E),而没食子黄素则以剂量依赖的方式增加了IFN-β的mRNA表达(图5E)。
接下来,作者测试了IFN-β在添加乳酸和/或HSPA6敲低的细胞中的诱导情况。当用乳酸处理HSPA6敲低的细胞时,乳酸对IFN-β的抑制作用减弱(图5F),这表明HSPA6通过乳酸-乳酸化轴负调控IFN-β的诱导。
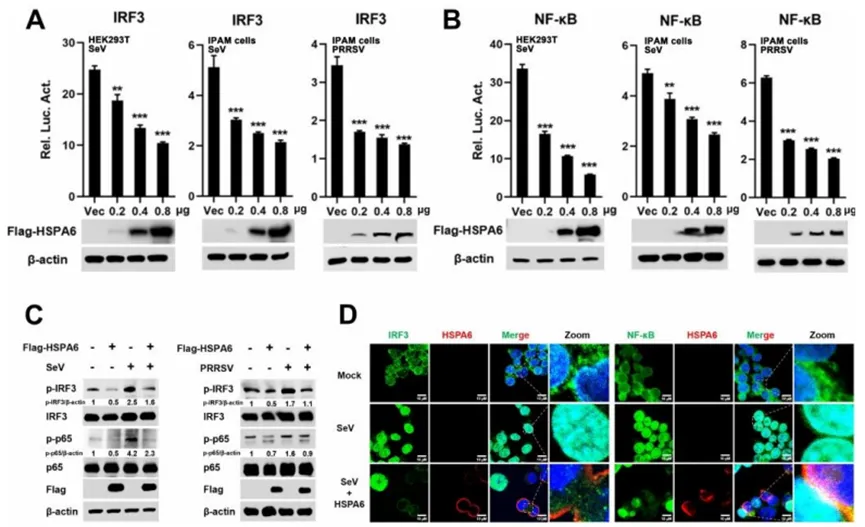
06 HSPA6抑制转录因子IRF3和NF-κB的激活
干扰素调节因子3(IRF3)和核因子κB(NF-κB)是触发IFN-β产生的关键转录调控因子。为了深入探究HSPA6是否通过削弱SeV或PRRSV诱导的IRF3和NF-κB激活来减少IFN-β的生成,作者设计了一项实验:在HEK293T和IPAM细胞中,将荧光素酶报告质粒IRF3-luc或NF-κB-luc与pRL-TK质粒以及不同剂量的HSPA6表达构建体或空载体进行共转染。24小时后,细胞被SeV或PRRSV感染12小时。如图6A和B所示,与对照组相比,在两种细胞中,HSPA6以剂量依赖的方式显著抑制了SeV或PRRSV诱导的IRF3和NF-κB激活。
众所周知,IRF3和NF-κB在进入细胞核并激活IFN-β转录之前,需要经过磷酸化激活的步骤。因此,作者进一步探究了HSPA6对IRF3和NF-κB的p65亚基磷酸化水平以及核易位的影响。不出所料,HSPA6的过表达降低了SeV和PRRSV感染后IRF3和p65的磷酸化水平(图6C)。与Western blot结果相吻合的是,SeV诱导的IRF3和p65核易位也被HSPA6所阻断(图6D)。
接下来,作者又检测了乳酸和没食子黄素对PRRSV感染期间IRF3和NF-κB激活的影响。结果显示,乳酸处理后,PRRSV诱导的IRF3和NF-κB活性受损;相反,与对照组相比,没食子黄素治疗后,PRRSV诱导的IRF3和NF-κB激活得到增强。
综上所述,这些实验结果清晰地表明,HSPA6通过抑制IRF3和NF-κB的激活来对抗IFN-β的诱导。
结论
在本研究中,作者揭示了一个重要的机制:PRRSV感染能够触发乳酸的生成,而这种乳酸的产生通过抑制IFN-β的诱导来进一步促进PRRSV的增殖。此外,作者还发现PRRSV诱导产生的乳酸能够上调乳酸化修饰过程,进而激活IFN-β的负调控因子HSPA6的表达。综上所述,这些发现表明代谢过程、先天免疫应答以及病毒感染之间可能存在着协同进化的关系。因此,针对天然免疫与细胞代谢之间相互作用的深入研究,可能会为开发新型抗病毒策略提供宝贵的见解和思路。
| 名称 | 货号 | 规格 |
| Tom20 (D8T4N) Rabbit mAb | 42406T | 20ul |
| Tom20 (29) | sc-136211 | 200ug/ml |
| Tom20 (F-10) | sc-17764 | 200ug/ml |
| Tom20 (F-10) Alexa Fluor® 647 | sc-17764AF647 | 200ug/ml |



































