上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|E6调节宫颈癌潜在机制的深入探索
129 人阅读发布时间:2025-02-25 13:36
引言
宫颈癌,作为女性癌症死亡的第四大原因,对全球57万女性的健康构成了严重威胁。这一恶性肿瘤的主要危险因素在于高危型人乳头瘤病毒(HPV)的持续感染,特别是HPV16和HPV18这两种类型,占据了宫颈癌病例的绝大多数。HPV的致癌机制复杂多样,其中E6和E7病毒癌蛋白的作用尤为关键。它们通过降解和灭活肿瘤抑制因子p53和pRb,导致细胞周期调控失常,从而引发细胞的恶性转化。
近年来,科学家们对宫颈癌的发病机制进行了深入研究,特别是在mRNA翻译重编程方面取得了新的突破。mRNA翻译重编程是一种在许多疾病中普遍存在的现象,包括癌症和病毒感染。然而,病毒诱导的mRNA翻译改变是否有助于致癌,这一直是一个悬而未决的问题。
在一项发表在《Signal Transduction and Targeted Therapy》上的研究中,科学家们利用多核糖体分析和RNA测序技术,系统地评估了HPV18感染的宫颈癌细胞中E6调节的mRNA翻译情况。研究结果显示,E6通过调节特定mRNAs的翻译,产生了一种新的致癌机制。

研究内容
具体来说,研究团队在稳定转染E6沉默shRNA或靶向不相关LacZ基因的shRNA的HeLa细胞中,进行了多核糖体分析和RNA测序。他们共检测到了2400万个外显子映射的核糖体,对应15526个主动翻译的mRNAs。通过对比分析,他们鉴定出了445个翻译减少的mRNA和208个翻译增加的mRNA,且这些变化超过了两倍。
进一步的研究发现,当E6被沉默时,这些变化显著的蛋白质的翻译水平也显著下降。这表明E6确实通过调节mRNA的翻译来影响蛋白质的合成。KEGG功能富集分析结果显示,E6的分析结果显示广泛的致癌机制,而基于转录组的分析则主要局限于E6对核酸代谢和DNA修复的影响。
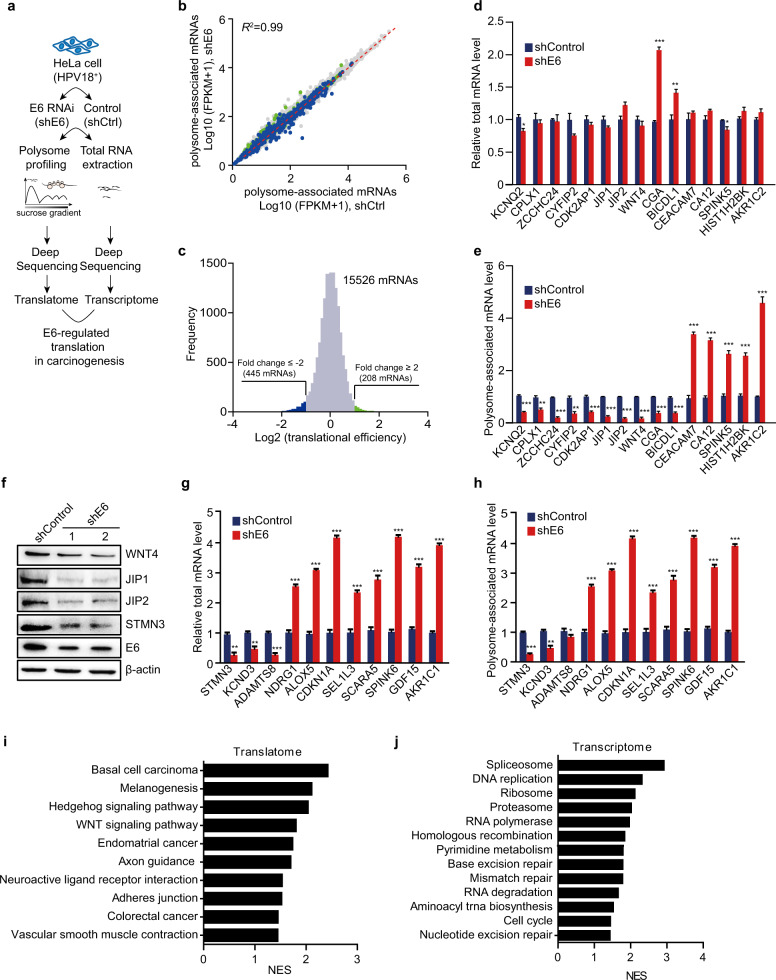
为了深入探究E6如何通过调节mRNA翻译来影响宫颈癌的进展,研究团队进一步关注了翻译效率变化显著的基因。他们发现,与癌症相关的基因转化效率高出两倍,且参与非经典WNT/PCP和MAPK/JNK通路的基因显著下调。有趣的是,E6能够增强WNT4、JIP1和JIP2的翻译,而不影响它们在HaCaT细胞中的转录。这表明E6可能通过选择性地上调这些基因的翻译来发挥致癌作用。
为了验证这一假设,研究团队进行了一系列实验。他们发现,敲除E6显著抑制了JNK的磷酸化,而恢复WNT4和JIP2的表达则可以挽救JNK的磷酸化水平。这表明E6确实通过增强WNT4和JIP2的翻译来激活WNT/PCP/JNK通路。
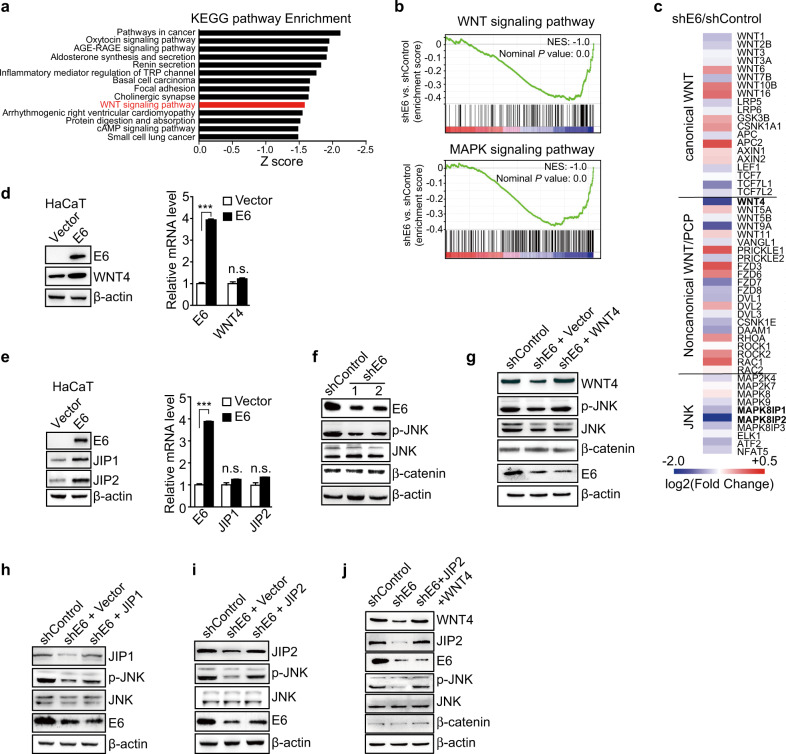
进一步的研究表明,E6通过激活WNT/PCP/JNK通路促进了宫颈癌细胞的增殖。敲除E6显著抑制了HeLa细胞的增殖,而恢复WNT4和JIP2的表达则可以部分或大部分恢复细胞增殖。此外,在肿瘤异种移植实验中,沉默E6导致肿瘤生长受到抑制,而恢复WNT4和JIP2的表达则可以挽救这种抑制效果。
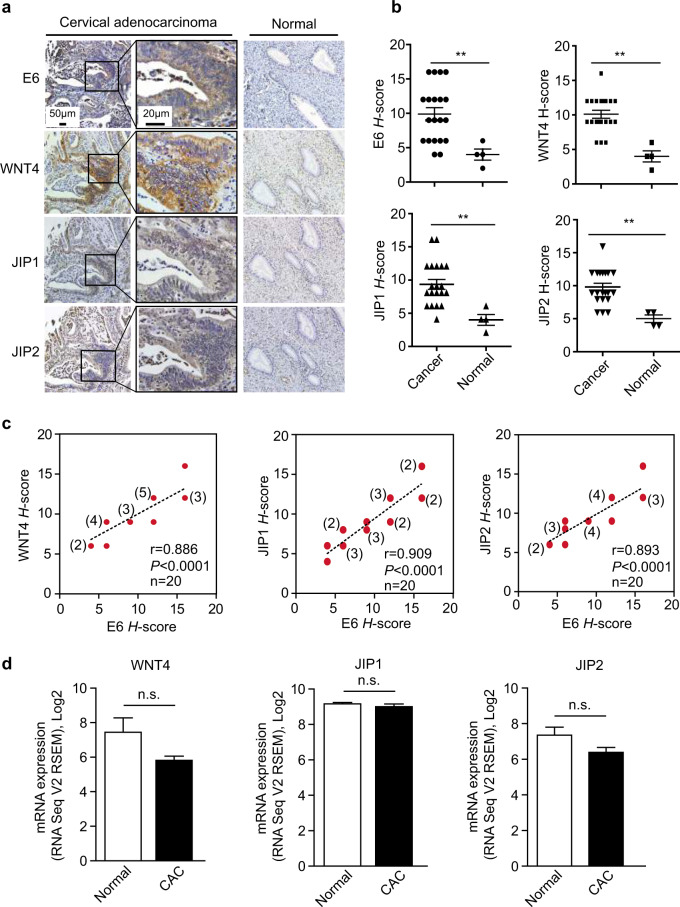
最后,研究团队还分析了人宫颈腺癌样本中E6、WNT4、JIP2和JIP1的表达情况。他们发现,在E6阴性的正常宫颈组织中,这些基因的染色水平非常低;而在E6阳性的宫颈腺癌样本中,这些基因的染色水平则显著升高。这表明E6与WNT4、JIP2和JIP1的表达水平存在正相关关系,进一步支持了E6通过调节WNT4/JIP2/JNK通路来促进宫颈癌进展的假设。
研究结论
综上所述,这项研究揭示了E6通过调节mRNAs的翻译而产生的一种新的致癌机制。E6可以选择性地上调WNT4、JIP1和JIP2的翻译,从而激活非经典的WNT/PCP/JNK通路,进而促进宫颈癌细胞的增殖和肿瘤的生长。这一发现为宫颈癌的治疗提供了新的靶点和思路,有望为宫颈癌患者带来更好的治疗效果和生存质量。
| 名称 | 货号 | 规格 |
| HPV18 E6 (289-13965) | sc-57835 | 200ug/ml |
| JIP-2 (1E11) | sc-53553 | 200ug/ml |
| β-Actin (C4) | sc-47778 | 200ug/ml |
| Wnt-4 (B-6) | sc-376279 | 200ug/ml |



































