上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|武汉同济医院研究取得新突破:双抗体YM101联合免疫治疗方案展现显著抗肿瘤效果
182 人阅读发布时间:2025-02-25 13:37
近日,一项令人瞩目的科研成果在《Journal of Hematology & Oncology》期刊上发表,题为《Combination of oral STING agonist MSA-2 and anti-TGF-β/PD-L1 bispecific antibody YM101: a novel immune cocktail therapy for non-inflamed tumors》。该研究由华中科技大学同济医学院附属同济医院肿瘤科的吴孔明教授团队与周鹏飞博士团队携手完成,共同揭示了双抗体YM101联合免疫治疗方案在抗肿瘤领域的巨大潜力。

近年来,以PD-1/PD-L1抗体为代表的免疫检查点阻断药物在多种癌症的治疗中取得了显著成效,然而,其总体有效率不高成为制约其广泛应用的关键因素。这一挑战主要源于肿瘤的异质性和免疫微环境的多样性。为了克服这一难题,研究者们开始探索以PD-1/PD-L1抗体为基础的联合治疗方案,以期提高疗效并降低耐药性。
在此背景下,吴孔明教授课题组共同开发出了一种创新的抗鼠PD-L1和TGF-β双特异抗体(YM101)。该抗体能够同时阻断PD-1/PD-L1和TGFR2/TGF-β信号通路,从而有效促进效应T细胞的活化,调节肿瘤微环境,逆转免疫抑制和纤维化。在多种小鼠荷瘤模型中,YM101展现出了优于PD-L1单抗的抗肿瘤效果。然而,在面对低免疫原性的免疫荒漠型(Immune-desert)小鼠肿瘤模型时,其疗效仍显有限。
为了进一步提升YM101的抗肿瘤效果,研究者们将目光转向了干扰素基因刺激因子(STING)激动剂。MSA-2作为全球首个口服的STING激动剂,其下游通路能够促进抗原呈递细胞(APC)的激活和细胞因子的释放,进而促进T细胞的启动和募集,激活先天免疫系统。这一特性使得MSA-2成为与YM101联合治疗的理想候选药物。
研究结果显示,YM101联合MSA-2的治疗方案在免疫豁免型(Immune-excluded)和免疫荒漠型(Immune-desert)肿瘤模型中均取得了优异的治疗效果。通过小鼠肿瘤实验,研究者们发现该联合治疗方案拥有更强的抗肿瘤效应。同时,肿瘤组织的单细胞RNA测序分析也进一步证实了联合治疗能够显著增强小鼠体内T细胞、自然杀伤细胞(NK)和树突状细胞(DC)等多种免疫细胞的抗肿瘤免疫反应。
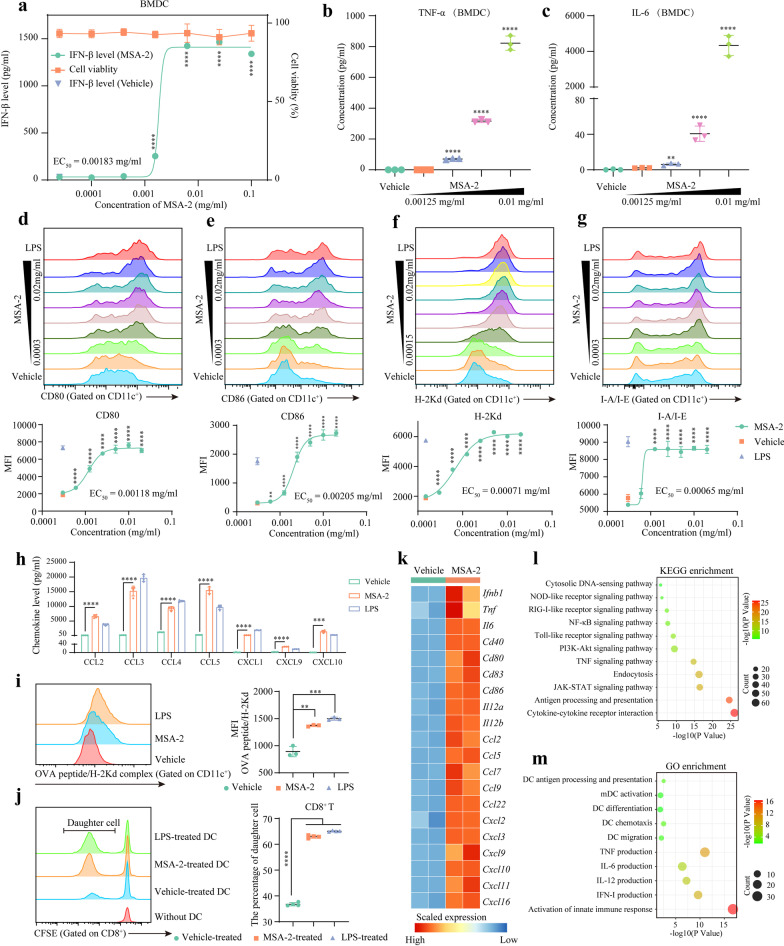
此外,该研究还揭示了联合治疗对肿瘤免疫微环境的重塑作用。单细胞组学数据显示,联合治疗有效地增加了多种类型的T细胞亚群的丰度,从而进一步增强了抗肿瘤免疫反应。这一发现不仅进一步证实了YM101对TGF-β高表达类型肿瘤的治疗效果,还极大地拓宽了其抗肿瘤谱。
基于TGF-β/PD-L1双抗体的联合疗法有望成为解决当前免疫治疗耐药性的全新解决方案。这一研究成果不仅具有重要的临床意义,还为TGF-β/PD-L1双抗体临床方案的设计提供了坚实的理论基础。随着研究的深入,这一创新疗法有望为更多肿瘤患者带来新的治疗希望。
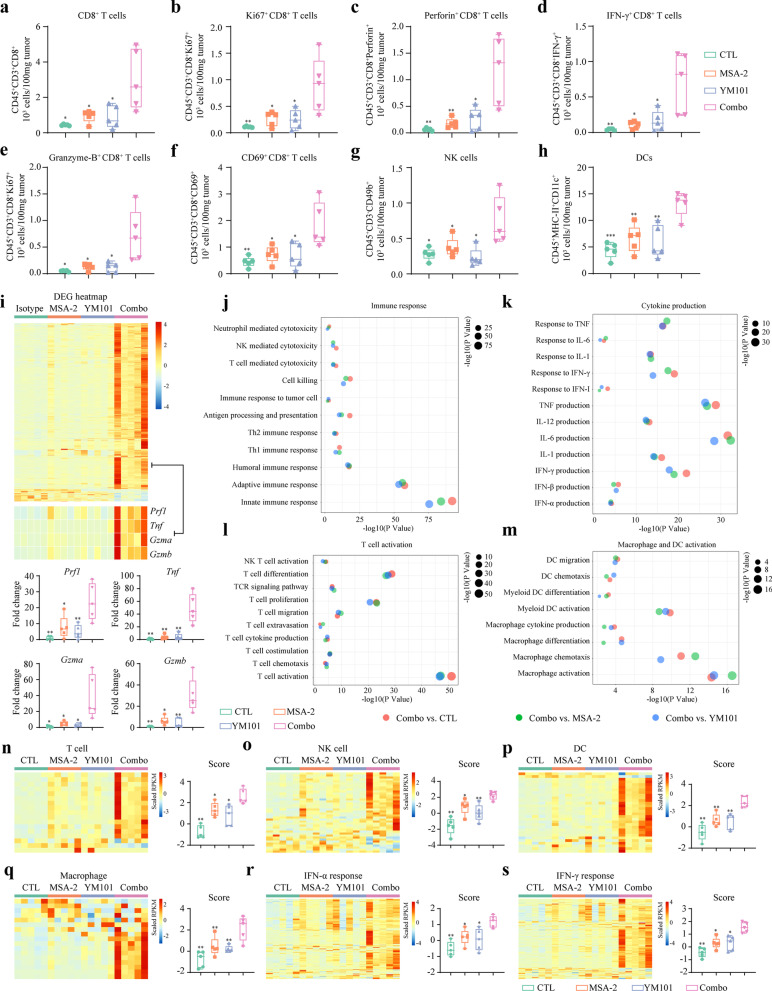
综上所述,武汉同济医院研究的双抗体YM101联合免疫治疗方案在抗肿瘤领域取得了重要突破。这一创新疗法不仅为肿瘤患者提供了新的治疗选择,还为免疫治疗领域的发展注入了新的活力。随着研究的不断深入和技术的不断进步,相信这一疗法将在未来发挥更大的作用,为更多患者带来福音。
| 名称 | 货号 | 规格 |
| Acetyl-CoA Carboxylase (C83B10) Rabbit mAb | 3676T | 20ul |
| Acetyl-CoA Carboxylase (C83B10) Rabbit mAb | 3676S | 100ul |
| PGD (G-2) | sc-398977 | 200ug/ml |
| G6PD (G-12) | sc-373886 | 200ug/ml |



































