上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|深入探索Atlastin介导的同型膜融合机制——基于单分子水平的研究
78 人阅读发布时间:2025-03-05 14:09
引言
细胞内的膜融合过程对于维持细胞结构和功能至关重要,特别是在内质网(Endoplasmic Reticulum, ER)这一广泛的膜网络中。内质网通过同型膜融合(homotypic membrane fusion)形成复杂的膜结构,这些结构对于细胞内的物质转运、信号传导以及细胞器的形成和功能都起着关键作用。近年来,研究揭示了一种名为Atlastin的动态膜蛋白在这一过程中发挥着核心作用。Atlastin属于动力蛋白样GTP酶(dynamin-like GTPase)家族,能够催化内质网膜的融合。然而,关于Atlastin如何精确调控膜融合的机制,特别是其在单分子水平上的动态行为,仍然不够清晰。本文将对一篇题为“Dissecting the mechanism of atlastin-mediated homotypic membrane fusion at the single-molecule level”的研究论文进行解析,该论文通过结合单分子荧光共振能量转移(FRET)成像技术和分子动力学模拟,揭示了Atlastin介导的同型膜融合的新机制。

研究背景与意义
内质网是细胞内的一个重要细胞器,它贯穿于整个细胞,形成一个动态且连续的网络,包括膜片和管状结构以及三向连接点。这种独特的结构是通过内质网膜的同型融合形成的,这一过程在动物细胞中由动力蛋白样膜蛋白Atlastin催化,在酵母中由Sey1p催化,而在植物中则由Root Hair Defective 3(RHD3)催化。内质网网络的完整性对于细胞功能至关重要,因为Atlastin的特定异构体与多种细胞过程相关联,包括骨形态发生蛋白信号通路、脂质滴大小调节、核膜组装、ER吞噬作用、COPII形成、自噬体形成和黄病毒复制等。人类Atlastin-1(ATL1)基因的突变与遗传性痉挛性截瘫(HSP)和遗传性感觉神经病I型(HSN1)有关。因此,深入研究Atlastin介导的膜融合机制,不仅有助于理解内质网的生物发生和维持,还能为相关疾病的病理机制提供新见解。
研究方法与技术
本研究采用了两种关键技术来探索Atlastin介导的同型膜融合机制:单分子FRET成像和分子动力学模拟。
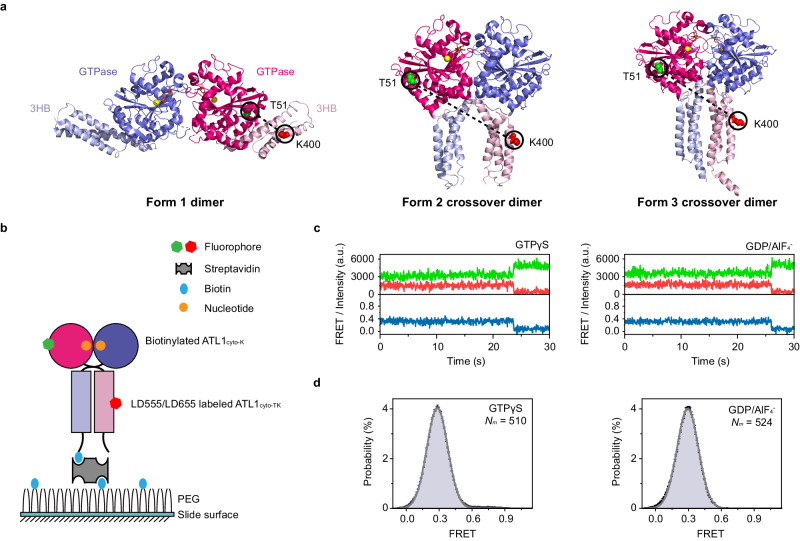
- 单分子FRET成像:FRET是一种非辐射能量转移过程,发生在两个足够接近的荧光分子之间。当一个荧光分子(供体)被激发时,它可以将能量转移到另一个荧光分子(受体),导致受体发光。通过测量供体和受体之间的FRET效率,可以推断出它们之间的距离和相对取向,从而揭示蛋白质在膜融合过程中的构象变化。
- 分子动力学模拟:这是一种计算机模拟技术,用于模拟生物分子的动态行为。通过模拟Atlastin在膜融合过程中的构象变化,研究人员可以深入了解其催化机制,并验证实验观察结果。
研究发现与解析
-
Atlastin的构象动力学
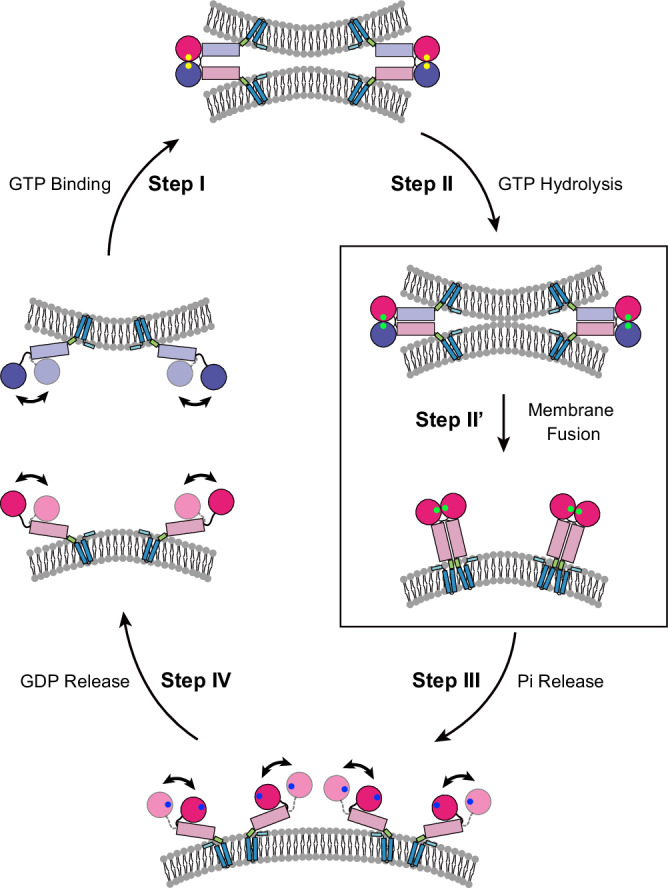
研究发现,Atlastin的N-末端区域(ATLcyto)在GTP依赖的域重排中起着关键作用,这些域包括GTP酶域和三个螺旋束(3HB)。然而,在GTP酶循环期间,其构象动力学一直难以捉摸。本研究通过单分子FRET成像和分子动力学模拟揭示了ATLcyto在膜融合过程中的构象变化。与普遍认为的模型不同,ATLcyto在GTP结合后可以形成一个松散的交叉二聚体,这种二聚体在GTP水解后被收紧,从而促进膜融合。
-
α-螺旋基序的功能
位于3HB和跨膜域之间的α-螺旋基序在膜融合过程中起着至关重要的作用。这一基序嵌入在脂质双层的表面,并在交叉二聚体中自我关联。研究发现,这一α-螺旋基序对于Atlastin的功能是必需的,因为它可能参与了膜融合过程中的脂质双层重排。
-
蛋白质的循环利用
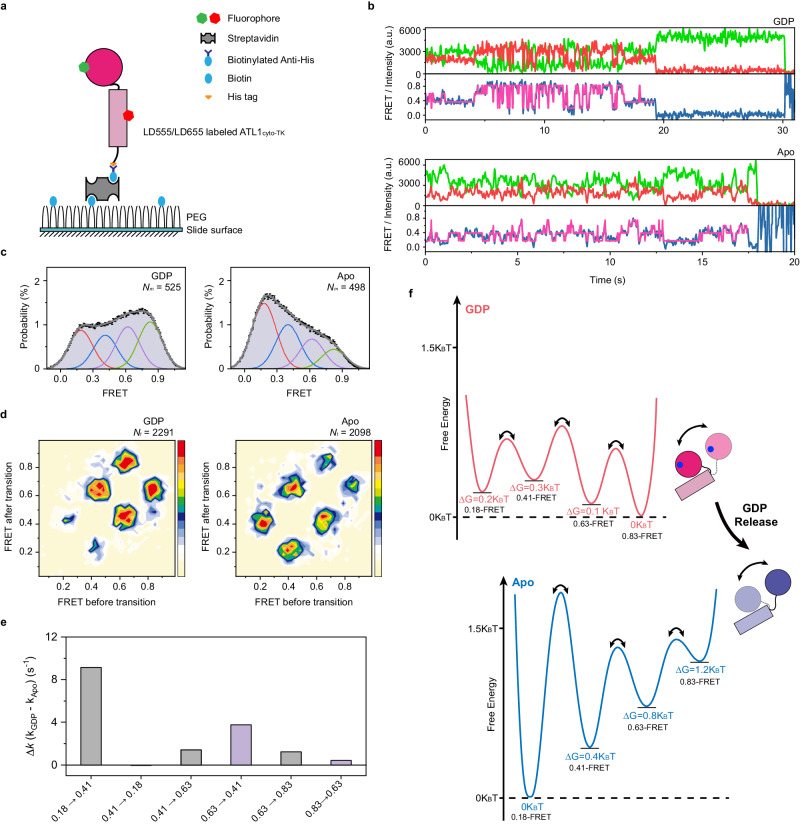
在膜融合完成后,Atlastin蛋白需要被循环利用以进行下一轮反应。本研究发现,无机磷酸(Pi)的释放可以拆解二聚体,激活GTP酶域和3HB之间的频繁相对运动,随后的GDP解离会改变ATLcytomonomer的构象偏好,使其能够进入下一个反应循环。
-
疾病相关突变的影响
研究还发现了两种影响人类ATL1活性的疾病相关突变。这些突变分别通过破坏GTP结合诱导的松散交叉二聚体形成和膜嵌入螺旋的稳定性,从而影响了Atlastin的功能。这些发现为理解相关疾病的病理机制提供了新视角。
结果与讨论
本研究的结果揭示了Atlastin介导的同型膜融合在单分子水平上的新机制。与以往的模型相比,本研究发现ATLcyto在GTP结合后可以形成一个松散的交叉二聚体,这种二聚体在膜融合过程中被收紧。这一发现不仅挑战了传统的膜融合模型,还为理解动力蛋白样GTP酶在膜融合过程中的作用提供了新的视角。此外,本研究还强调了α-螺旋基序在膜融合过程中的重要性,以及Pi释放和GDP解离在蛋白质循环利用中的关键作用。
同时,本研究还发现了两种影响人类ATL1活性的疾病相关突变,这些突变分别通过破坏GTP结合诱导的松散交叉二聚体形成和膜嵌入螺旋的稳定性来影响Atlastin的功能。这些发现不仅为理解遗传性痉挛性截瘫和遗传性感觉神经病I型的病理机制提供了新线索,还可能为这些疾病的治疗提供新的靶点。
结论与展望
本研究通过结合单分子FRET成像和分子动力学模拟,深入探索了Atlastin介导的同型膜融合机制。研究结果揭示了ATLcyto在膜融合过程中的构象动力学、α-螺旋基序的功能、蛋白质的循环利用以及疾病相关突变的影响。这些发现不仅加深了我们对内质网生物发生和维持的理解,还为相关疾病的病理机制和治疗提供了新视角。
未来的研究可以进一步探索Atlastin与其他膜融合蛋白的相互作用,以及Atlastin在不同细胞类型和生理条件下的功能差异。此外,还可以利用基因编辑技术和高通量筛选方法来鉴定更多影响Atlastin功能的突变,并探索这些突变在疾病发生和发展中的作用。这些研究将有助于我们更全面地理解Atlastin介导的膜融合机制,并为相关疾病的治疗提供新的策略和靶点。
总的来说,本研究揭示了Atlastin介导的同型膜融合在单分子水平上的新机制,为理解内质网的生物发生和维持、相关疾病的病理机制以及潜在的治疗靶点提供了重要信息。这一发现不仅具有理论意义,还具有潜在的临床应用价值。
| 名称 | 货号 | 规格 |
| Recombinant Viral PreScission Protease | abs01243-100IU | 100IU |
| Recombinant Viral PreScission Protease | abs01243-250IU | 250IU |
| NI SEPHAROSE 6FF, 100 ML | 17531802 | 100ml |
| GLUTATHIONE SEPHAROSE 4FF,25ML | 17513201 | 25ml |