上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|聚米星B修饰脂质体吸附脂多糖并缓解炎症在动脉粥样硬化治疗中的研究
70 人阅读发布时间:2025-03-06 13:41
一、引言
动脉粥样硬化(Atherosclerosis,AS)是一种慢性炎症性疾病,其发病机制复杂,涉及多种细胞类型和分子机制的相互作用。近年来,越来越多的研究表明,循环系统中的脂多糖(Lipopolysaccharide,LPS)水平升高与动脉粥样硬化的严重程度密切相关。LPS作为一种重要的炎症因子,能够驱动巨噬细胞向M1型极化,加剧炎症反应,并最终促进动脉粥样硬化的进展。因此,针对循环系统中的LPS进行干预,为动脉粥样硬化的治疗提供了新的思路。
本文题为《聚米星B修饰脂质体吸附脂多糖并缓解炎症在动脉粥样硬化治疗中的研究》,旨在探讨一种新型的动脉粥样硬化治疗方法。该方法利用聚米星B(Polymyxin B,PMB)与PEG化脂质体(PEGylated liposomes,PLPs)的结合,通过特异性相互作用吸附循环系统中的LPS,从而降低LPS水平,减轻炎症反应,进而抑制动脉粥样硬化的进展。

二、背景与研究意义
动脉粥样硬化是心血管疾病的主要病理基础之一,其发病机制涉及内皮细胞损伤、脂质沉积、炎症反应等多个环节。在这些环节中,炎症反应起着至关重要的作用。大量研究表明,循环系统中的LPS水平与动脉粥样硬化的严重程度呈正相关。LPS作为一种革兰氏阴性菌细胞壁的主要成分,在感染、炎症等病理状态下可释放入血,进而激活免疫系统,引发炎症反应。
巨噬细胞在动脉粥样硬化的发生和发展中扮演着重要角色。根据功能和表型的不同,巨噬细胞可分为M1型和M2型。M1型巨噬细胞具有促炎作用,能够分泌大量的炎症因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)等,从而加剧炎症反应。而M2型巨噬细胞则具有抗炎作用,能够促进组织修复和炎症消退。在动脉粥样硬化的病理过程中,巨噬细胞主要向M1型极化,导致炎症反应持续存在并加剧。
因此,降低循环系统中的LPS水平,抑制巨噬细胞向M1型极化,成为治疗动脉粥样硬化的重要策略之一。本研究利用聚米星B与PEG化脂质体的结合,通过特异性相互作用吸附LPS,从而降低其水平,减轻炎症反应,为动脉粥样硬化的治疗提供了新的思路和方法。
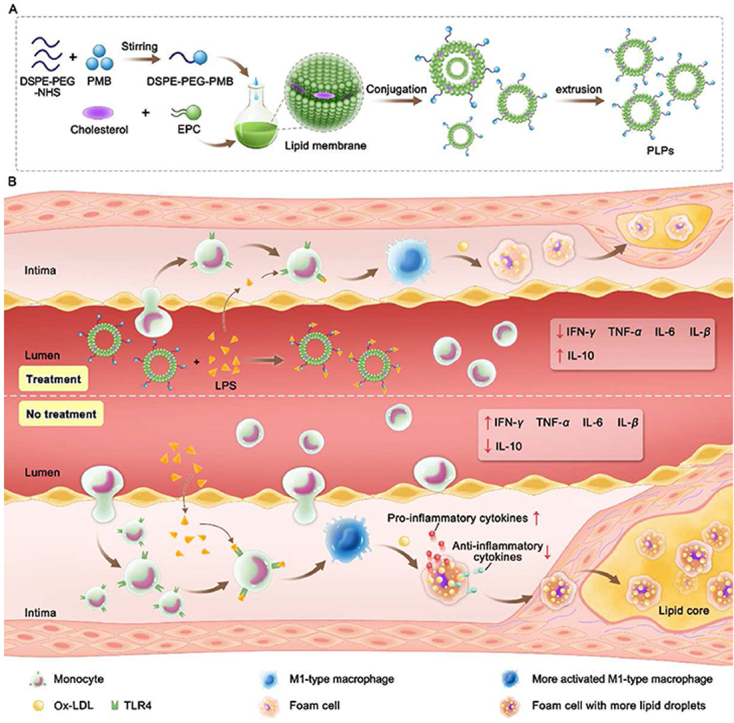
三、研究方法与实验设计
本研究采用了一种创新的策略,即利用聚米星B与PEG化脂质体的结合来吸附循环系统中的LPS。聚米星B是一种多肽类抗生素,具有与LPS特异性结合的能力。PEG化脂质体则是一种常用的药物载体,具有良好的生物相容性和稳定性。通过将聚米星B共价连接到PEG化脂质体上,可以制备出具有LPS吸附能力的PLPs。
在实验设计上,本研究分为体外实验和体内实验两部分。体外实验主要验证了PLPs对LPS的吸附能力,以及其对巨噬细胞极化和泡沫细胞形成的影响。体内实验则进一步探讨了PLPs在动脉粥样硬化模型动物中的治疗效果。
四、实验结果与数据分析
(一)体外实验结果
- PLPs对LPS的吸附能力
通过紫外-可见分光光度法检测,本研究发现PLPs对LPS具有显著的吸附能力。在设定的浓度范围内,随着PLPs浓度的增加,其对LPS的吸附量也逐渐增加。这表明PLPs可以有效地吸附循环系统中的LPS,从而降低其水平。
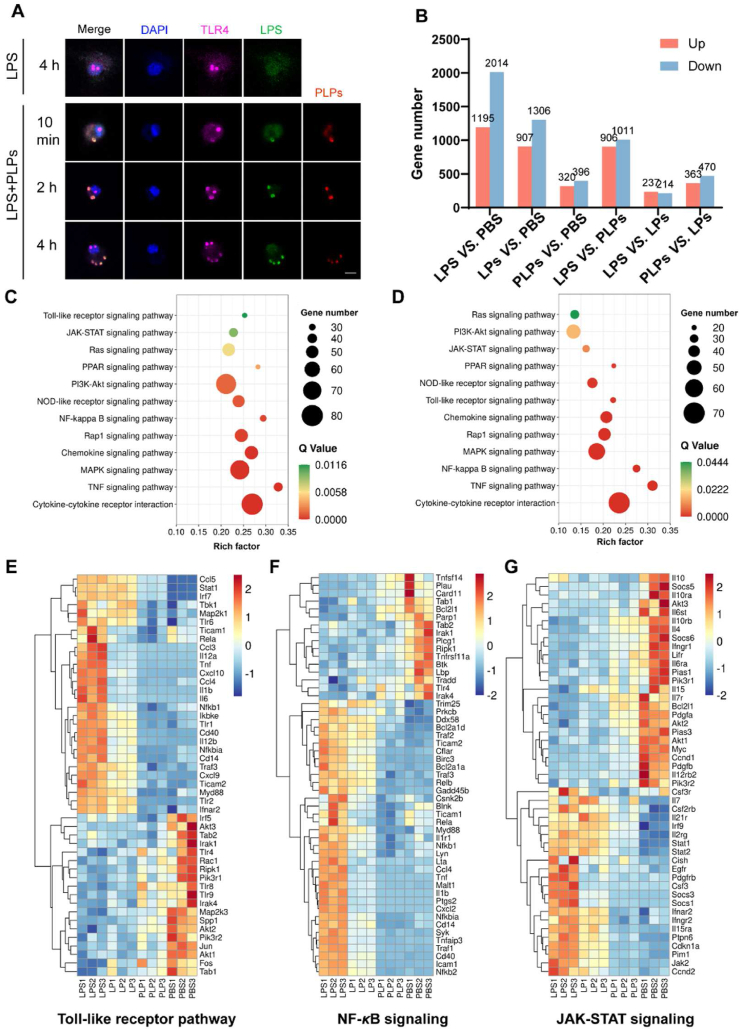
- PLPs对巨噬细胞极化的影响
利用流式细胞术和免疫荧光染色等方法,本研究探讨了PLPs对巨噬细胞极化的影响。结果发现,与未经处理的巨噬细胞相比,PLPs处理后的巨噬细胞向M1型极化的比例显著降低,而向M2型极化的比例有所增加。这表明PLPs能够抑制巨噬细胞向M1型极化,从而减轻炎症反应。
- PLPs对泡沫细胞形成的影响
泡沫细胞是动脉粥样硬化斑块中的重要细胞成分,其形成与巨噬细胞的脂质摄取和代谢异常有关。本研究通过油红O染色等方法检测了PLPs对泡沫细胞形成的影响。结果发现,PLPs处理后的巨噬细胞形成的泡沫细胞数量显著减少。这表明PLPs能够抑制泡沫细胞的形成,从而减轻动脉粥样硬化的病理过程。
(二)体内实验结果
- PLPs对动脉粥样硬化模型动物的治疗效果
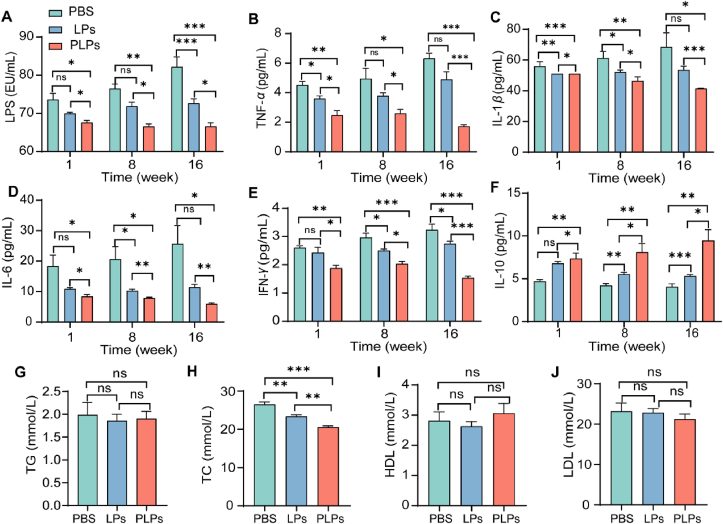
为了验证PLPs在动脉粥样硬化治疗中的效果,本研究建立了动脉粥样硬化模型动物,并给予PLPs治疗。通过定期检测血清中LPS和炎症因子水平、动脉粥样硬化斑块面积和比例等指标,评估了PLPs的治疗效果。
结果发现,与未经治疗的模型动物相比,PLPs治疗后的模型动物血清中LPS和炎症因子水平显著降低,动脉粥样硬化斑块面积和比例也有所减小。这表明PLPs能够有效地降低循环系统中的LPS水平,减轻炎症反应,并抑制动脉粥样硬化的进展。
- PLPs对动脉粥样硬化斑块稳定性的影响
动脉粥样硬化斑块的稳定性是影响其破裂和导致心血管事件的重要因素之一。本研究通过组织学染色和免疫荧光染色等方法检测了PLPs对动脉粥样硬化斑块稳定性的影响。结果发现,PLPs治疗后的模型动物动脉粥样硬化斑块中的胶原纤维含量增加,炎性细胞浸润减少,这表明PLPs能够增强动脉粥样硬化斑块的稳定性,从而降低其破裂的风险。
五、研究结论与讨论
本研究通过制备聚米星B修饰的PEG化脂质体(PLPs),成功实现了对循环系统中LPS的特异性吸附。体外实验表明,PLPs能够有效地吸附LPS,抑制巨噬细胞向M1型极化,并抑制泡沫细胞的形成。体内实验则进一步验证了PLPs在动脉粥样硬化治疗中的效果,表明其能够降低血清中LPS和炎症因子水平,减小动脉粥样硬化斑块面积和比例,并增强斑块的稳定性。
本研究不仅为动脉粥样硬化的治疗提供了新的策略和方法,也为LPS相关疾病的治疗提供了新的思路。然而,本研究仍存在一些局限性。例如,本研究仅探讨了PLPs在动脉粥样硬化模型动物中的治疗效果,而未对其在人体中的安全性和有效性进行验证。因此,在未来的研究中,需要进一步完善PLPs的临床前和临床研究,以评估其在动脉粥样硬化治疗中的潜力和应用前景。
此外,本研究还发现PLPs对动脉粥样硬化的治疗作用可能与其抑制炎症反应和调节巨噬细胞极化有关。然而,其具体作用机制仍需进一步深入研究。未来的研究可以探讨PLPs与LPS结合后的信号转导途径、下游靶点的变化以及与其他药物的联合应用效果等,以更全面地了解PLPs在动脉粥样硬化治疗中的作用机制。
六、研究展望
随着对动脉粥样硬化发病机制的不断深入了解和新型治疗方法的不断涌现,动脉粥样硬化的治疗前景日益广阔。本研究利用聚米星B修饰的PEG化脂质体(PLPs)成功实现了对循环系统中LPS的特异性吸附,为动脉粥样硬化的治疗提供了新的策略和方法。然而,要真正实现PLPs在临床上的应用,还需要进行大量的研究和实践。
在未来的研究中,可以进一步探讨PLPs的制备工艺优化、稳定性评估、药效学及药代动力学研究等方面的工作,以提高其制备效率和治疗效果。同时,也需要开展更多的临床研究来验证PLPs在人体中的安全性和有效性,并探索其与其他药物的联合应用效果,以更好地满足动脉粥样硬化患者的治疗需求。
此外,随着生物技术和纳米技术的不断发展,未来还可以探索更多基于纳米材料的新型治疗方法,如纳米药物载体、纳米疫苗等,为动脉粥样硬化的治疗提供更多的选择和可能性。相信在不久的将来,我们能够开发出更加安全、有效、便捷的动脉粥样硬化治疗方法,为心血管疾病患者带来更好的治疗效果和生活质量。
| 名称 | 货号 | 规格 |
| Donkey anti-Goat IgG-AF488 Antibody | abs20026-500ul | 500ul |
| Donkey anti-Goat IgG-AF488 Antibody | abs20026-100ul | 100ul |
| Purified Rat Anti-Mouse CD31(MEC 13.3) | 550274 | 1mL |
| FLUOSPHERES CARBOXYLAT | F8801 | 10ML |



































