上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|胶原蛋白促进肝癌细胞干细胞性的机制研究
155 人阅读发布时间:2025-04-25 11:07
一、引言
胶原蛋白作为人体内最丰富的蛋白质之一,其在维持皮肤弹性、骨骼强度以及多种组织结构的稳定性方面发挥着重要作用。然而,近年来的研究表明,胶原蛋白在某些病理条件下,如癌症中,也可能发挥重要的生物学效应。尤其是,胶原蛋白在肝细胞癌(HCC)中的表达上调引起了广泛关注。本文将详细解析一篇关于胶原蛋白在促进肝癌细胞干细胞性中的作用的最新研究,探讨其分子机制及潜在的临床应用前景。

二、实验方法与材料
该研究采用了多种先进的实验技术和方法来探究胶原蛋白在肝癌细胞中的作用。具体包括:HLF、Hep3B、SK-Hep1和HEK293 T细胞培养,Sphere Assay(球体形成实验),克隆形成实验,流式细胞术分析,药物抵抗和IC50测定,质粒和慢病毒敲低小RNA技术,考马斯亮蓝染色,质谱分析,反转录PCR和RT-qPCR,免疫印迹,免疫共沉淀(co-IP),谷胱甘肽S转移酶(GST)pull-down,免疫荧光,共聚焦显微镜成像,荧光素酶报告基因实验,异种移植肿瘤形成,体内药物治疗,以及RNA-Seq等。这些方法的综合运用使得研究者能够全面而深入地揭示胶原蛋白在肝癌细胞中的生物学效应及其分子机制。
三、研究结果与讨论
- 高胶原蛋白I和DDR1水平预示HCC患者预后不良
研究者首先对HCC组织进行了Picro-Sirius red染色,以分析肿瘤内胶原的类型。结果显示,Ⅰ型胶原占胶原的比例最高。随后,研究者检测了123例具有相应临床病理特征的HCC组织芯片中Ⅰ型胶原的表达。与高分化HCC组织相比,Ⅰ型胶原在中分化HCC组织中高表达,在低分化组织中表达最高。Kaplan-Meier分析进一步显示,肿瘤中Ⅰ型胶原蛋白高表达的患者比Ⅰ型胶原蛋白低表达的患者具有更低的总生存率和更高的复发率。这些结果表明,Ⅰ型胶原在HCC中的高表达与不良预后密切相关。
此外,研究者还检测了DDR1在HCC中的表达,并发现DDR1与Ⅰ型胶原呈正相关。根据Ⅰ型胶原和DDR1表达情况,将患者分为三组:Col1+DDR1+(Ⅰ型胶原/DDR1双高表达),Col1+DDR1-或Col1-DDR1+(Ⅰ型胶原或DDR1单高表达),以及Col1-DDR1-(Ⅰ型胶原/DDR1双低表达)。与其他组相比,Col1+DDR1+组的总生存时间和无病生存时间最短。这些结果进一步支持了Ⅰ型胶原和DDR1在HCC发生和发展中的重要作用,并提示它们可能作为预测HCC患者预后的生物标志物。
- 胶原I-DDR1信号增强肿瘤干细胞特征
为验证DDR1对肝癌细胞干性的影响,研究者进行了球体形成实验(Sphere Assay)。结果发现,与相应培养的贴壁细胞(non-CSCs)相比,DDR1蛋白水平在HCC球(CSCs)中显著上调。DDR1作为维持干细胞自我更新潜能的关键转录因子和膜蛋白,其过表达可促进SOX2、NANOG和EPCAM的mRNA表达。I型胶原刺激进一步放大了这种效应。此外,DDR1过表达或I型胶原刺激还可诱导球形成效率、CD133阳性细胞数、单细胞克隆形成以及对sorafenib或doxorubicin的耐药性显著增加。这些结果表明,DDR1在体外可促进肝癌细胞的干性特征。
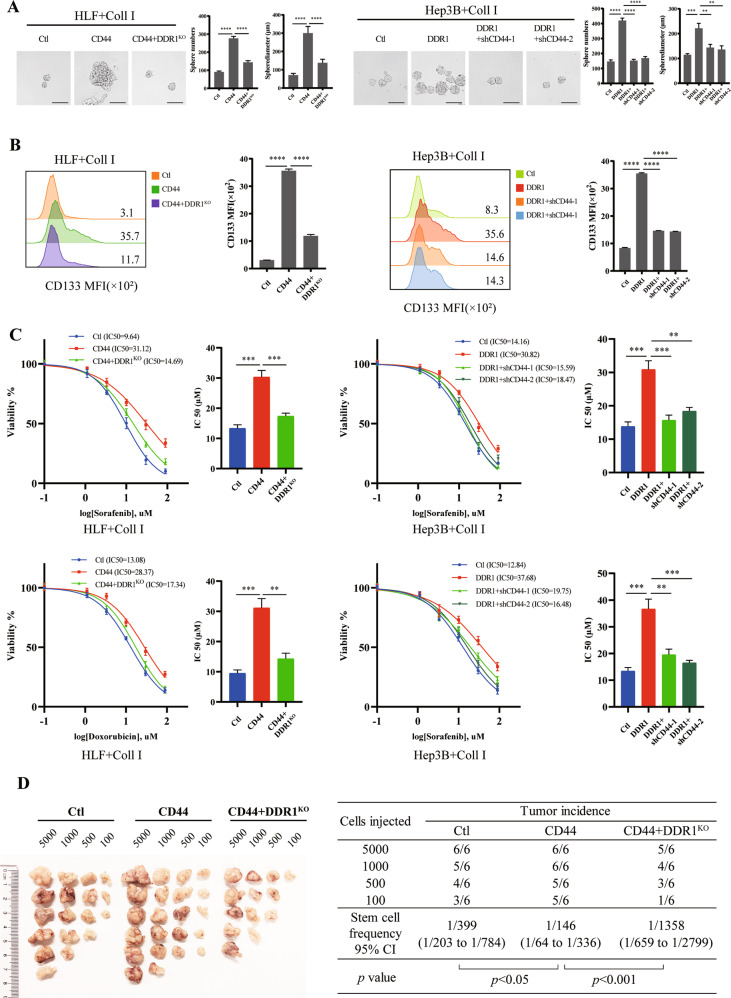
在体内实验中,研究者使用异种移植模型来检测DDR1在肝癌细胞中的作用。DDR1敲低成球细胞形成的皮下瘤明显小于scramble细胞形成的皮下瘤。进一步的研究还发现,DDR1过表达显著增强肿瘤形成能力并增加干细胞频率。这些结果表明,DDR1在体内同样可促进肝癌细胞的干性和肿瘤发生,且这种作用依赖于其激酶活性和胶原刺激。
- 胶原诱导的DDR1激活是由CD44协同促进的
为探究DDR1在肝细胞癌中的分子机制,研究者使用IP/MS方法研究了DDR1的相互作用蛋白。结果发现,CD44(CSCs标记物)是DDR1潜在的相互作用蛋白之一。免疫共沉淀(Co-IP)和谷胱甘肽S-转移酶(GST)pull-down实验进一步证实了DDR1与CD44的相互作用和结合。此外,免疫荧光和激光共聚焦检测还显示外源性DDR1和CD44在293T细胞中的空间共定位。在HLF细胞中观察到类似的内源性DDR1和CD44表达。这些结果表明,DDR1与CD44在肝细胞癌中存在紧密的相互作用。
随后的研究发现,胶原蛋白I可增加DDR1与CD44的相互作用。CD44敲低可降低DDR1的酪氨酸磷酸化,而过表达CD44则以时间依赖的方式促进Ⅰ型胶原诱导的DDR1磷酸化。这些结果表明,CD44可促进Ⅰ型胶原诱导的肝癌细胞DDR1的活化。进一步的研究还发现,DDR1是CD44介导的肝癌细胞干性信号所必需的关键蛋白。这些发现揭示了CD44在胶原诱导的DDR1活化及肝癌细胞干性特征中的重要作用。
- DDR1通过促进PP2AA募集到MST1/2而使Hippo信号失活
为确定DDR1影响HCC细胞干性的途径,研究者对DDR1敲低的HCC细胞和对照细胞进行了RNA测序。KEGG通路分析发现DDR1缺失显著改变了Hippo信号通路。Hippo信号通路与肿瘤干性密切相关,因此研究者进一步检测了DDR1对Hippo通路核心蛋白YAP/TAZ下游基因表达的影响。结果显示,DDR1过表达可促进CTGF、CYR61、BCL2和AXL的mRNA水平上调,而胶原蛋白I的存在进一步增强了这些作用。相反,DDR1敲低则显著降低这些基因的表达。这些结果表明,DDR1可影响Hippo信号通路的活性。
进一步的研究发现,DDR1过表达可促进YAP易位进入细胞核,并增强YAP的激活。而DDR1敲除则表现出相反的效果。这些结果表明,胶原I-DDR1信号通路可诱导YAP活化。此外,研究者还发现PP2AA作为经典的上游磷酸酶,可使MST1/2去磷酸化,从而使Hippo信号通路失活。募集实验表明DDR1以胶原依赖的方式促进PP2AA向MST1的募集。这些结果表明,PP2AA是胶原I-DDR1信号诱导YAP活化所必需的。这些发现揭示了DDR1通过促进PP2AA募集到MST1/2而使Hippo信号失活的分子机制。
- 联合抑制DDR1和YAP在肝癌细胞干性中具有协同作用
为验证DDR1是否通过YAP发挥作用,研究者使用了DDR1抑制剂(7rh)和YAP抑制剂(verteporfin; VP)进行体外和体内实验。结果显示,单独使用7rh或VP处理可减少成球效率、克隆形成和CD133+细胞比例的细胞数量,并减少移植瘤的体积和重量。与单药相比,7rh和VP联合处理进一步减弱了这些效应。这些结果表明,DDR1和YAP在肝癌细胞干性中具有协同作用,且联合抑制DDR1和YAP可更有效地抑制肝癌细胞的生长和干性特征。这些发现为肝癌的治疗提供了新的策略。
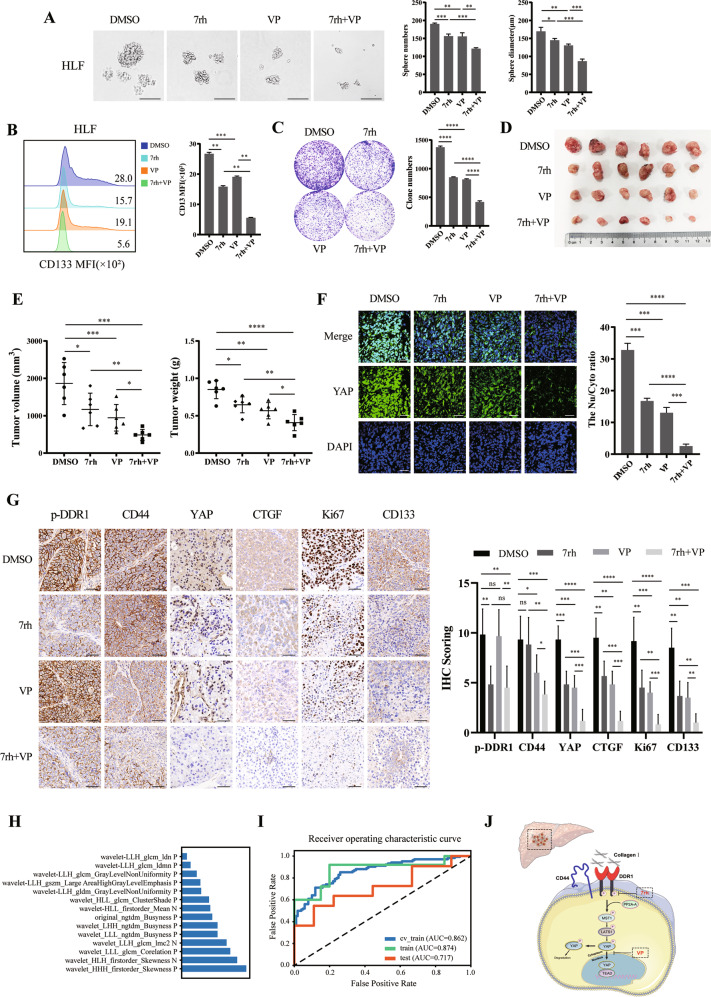
四、结论与展望
本研究通过综合运用多种先进的实验技术和方法,深入探讨了胶原蛋白在肝癌细胞中的作用及其分子机制。研究发现,CD44介导的胶原I-DDR1信号作为肿瘤激励因子,通过募集PP2AA激活YAP来促进HCC细胞的干细胞性。在HCC组织中,胶原I和DDR1表达的增加预示着预后不良,因此它们可作为HCC有希望的生物标志物和新的治疗策略。此外,联合抑制DDR1和YAP在肝癌细胞干性中具有协同作用,为肝癌的治疗提供了新的思路和方法。
然而,本研究仍存在一些局限性。例如,研究主要集中在胶原I和DDR1的作用上,而对其他类型的胶原和受体是否也具有类似作用尚不清楚。此外,虽然联合抑制DDR1和YAP在体外和体内实验中均表现出显著的抗肿瘤效果,但其临床应用前景仍需进一步验证和评估。因此,未来的研究应继续深入探究胶原蛋白在肝癌中的生物学效应及其分子机制,并探索更多有效的治疗策略和方法,以更好地服务于肝癌患者的治疗和管理。



































