上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|光感受器靶向细胞外囊泡介导的Cul7 siRNA传递在视网膜变性治疗中的研究
58 人阅读发布时间:2025-05-07 11:10
一、引言
视网膜变性(Retinal Degeneration,RD)是一类严重影响视力的疾病,其主要病理特征是光感受器的丧失。尽管医学界在再生医学领域取得了诸多进展,但针对视网膜变性的治疗方法仍然有限。RNA干扰(RNA Interference,RNAi)作为基因治疗的一种新方法,因其高效性和特异性,在视网膜变性治疗中具有广阔的应用前景。然而,如何将RNAi疗法有效递送至光感受器,以及缺乏有效的治疗靶点,仍是当前治疗视网膜变性面临的主要挑战。
近期,一篇题为《Photoreceptor-targeted extracellular vesicles-mediated delivery of Cul7 siRNA for retinal degeneration therapy》的研究论文,在视网膜变性治疗领域取得了重要突破。该研究团队通过开发一种新型的光感受器靶向细胞外囊泡(Photoreceptor-derived Extracellular Vesicles,PEVs)递送系统,成功将针对Cullin-7(Cul7)的siRNA递送至光感受器,实现了对视网膜变性的有效治疗。

二、研究背景与目的
视网膜变性是一类由多种遗传因素和环境因素引起的慢性疾病,其发病机制复杂,涉及光感受器的逐渐退化和死亡。目前,临床上尚无有效的治疗方法能够逆转或阻止视网膜变性的进程。因此,寻找新的治疗靶点和开发高效的递送系统,对于视网膜变性治疗具有重要意义。
Cullin-7(Cul7)是一种重要的细胞周期调控蛋白,近年来被发现与多种疾病的发生和发展密切相关。在视网膜变性中,Cul7的异常表达可能导致光感受器的损伤和死亡。因此,本研究团队旨在通过开发一种光感受器靶向的细胞外囊泡递送系统,将针对Cul7的siRNA递送至光感受器,以抑制Cul7的表达,从而实现对视网膜变性的治疗。
三、研究方法
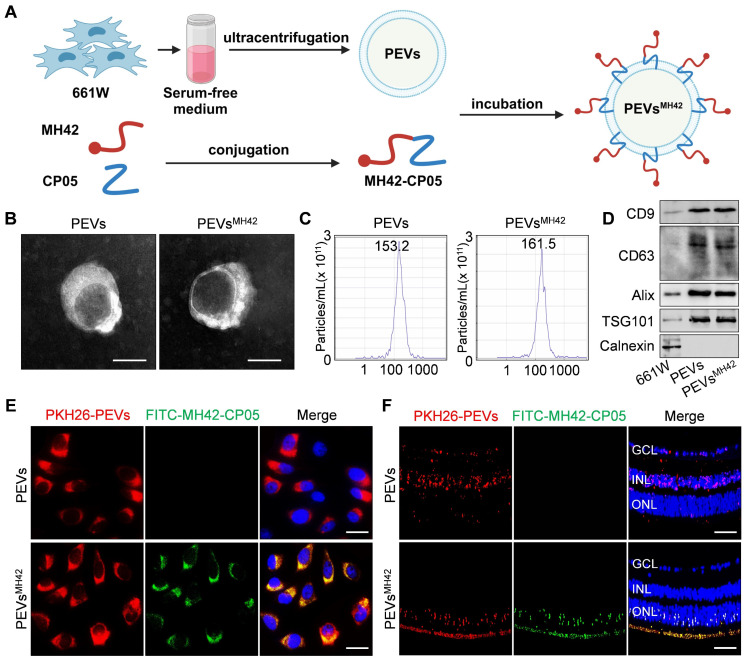
- 制备光感受器靶向细胞外囊泡(PEVsMH42):研究团队首先利用锚定肽CP05制备了与光感受器结合肽MH42共价偶联的光感受器靶向细胞外囊泡(PEVsMH42)。这种囊泡具有高度的光感受器选择性,能够有效地将携带的治疗物质递送至光感受器。
- 转录组测序筛选治疗靶点:为了确定RD的潜在治疗靶点,研究团队对视网膜变性小鼠的视网膜组织进行了转录组测序。通过生物信息学分析,成功筛选出Cullin-7(Cul7)作为RD的新治疗靶点。
- 构建PEVsMH42-siCul7递送系统:研究团队通过电穿孔法将针对Cul7的siRNA装载到PEVsMH42中,构建了PEVsMH42-siCul7递送系统。该系统能够高效地将siCul7递送至光感受器,并抑制Cul7的表达。
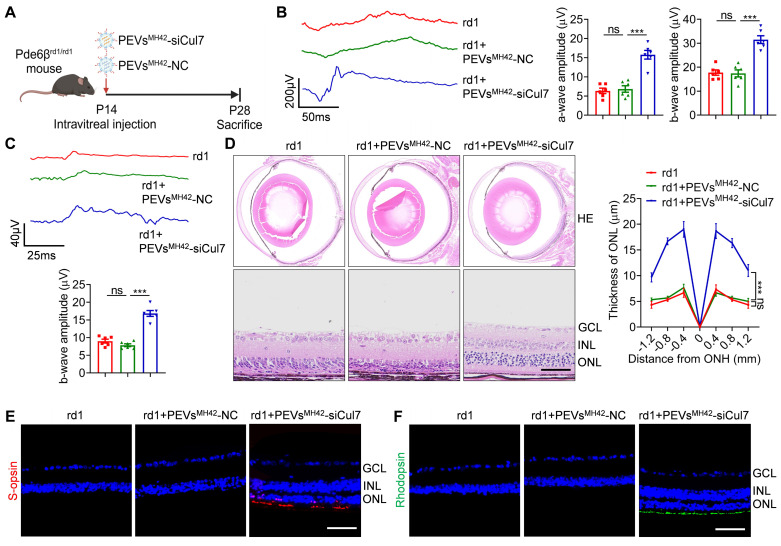
- 动物模型验证治疗效果:为了验证PEVsMH42-siCul7递送系统的治疗效果,研究团队选择了N-甲基-N-亚硝基脲(MNU)诱导的RD小鼠模型和Pde6βrd1/rd1突变小鼠模型进行实验。通过检测视网膜的形态学变化、光感受器存活率以及视觉功能等指标,评估了PEVsMH42-siCul7对视网膜变性的治疗效果。
四、研究结果
- PEVsMH42具有高度的光感受器选择性:研究结果显示,PEVsMH42在玻璃体注射后能够选择性地在光感受器中积累,这表明PEVsMH42具有高度的光感受器选择性。
- Cullin-7被确定为RD的新治疗靶点:通过转录组测序和生物信息学分析,研究团队成功筛选出Cullin-7作为RD的新治疗靶点。进一步的研究发现,Cul7的异常表达与光感受器的损伤和死亡密切相关。
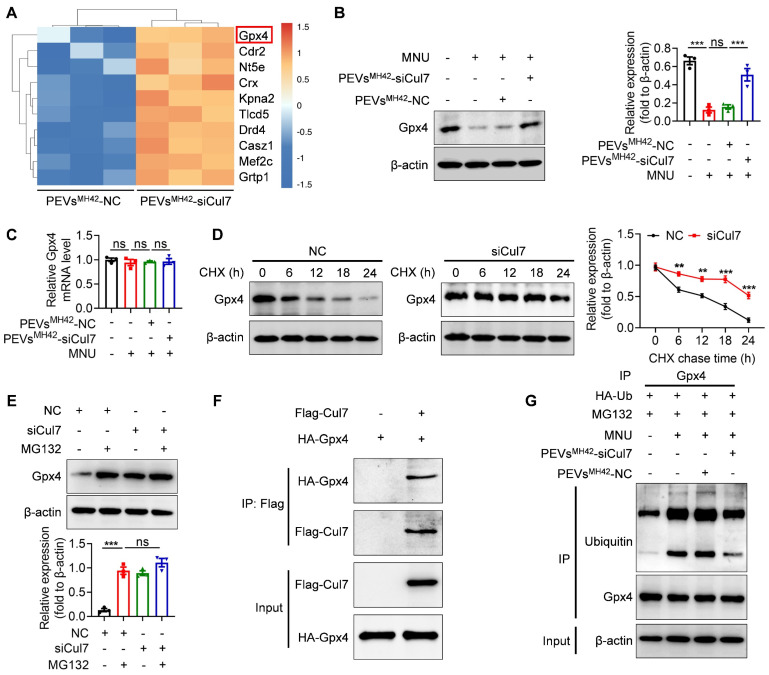
- PEVsMH42-siCul7有效抑制Cul7表达:研究结果显示,PEVsMH42-siCul7递送系统能够高效地将siCul7递送至光感受器,并显著抑制Cul7的表达。这进一步证实了PEVsMH42-siCul7递送系统的有效性和特异性。
- PEVsMH42-siCul7显著改善视网膜变性:在MNU诱导的RD小鼠模型和Pde6βrd1/rd1突变小鼠模型中,PEVsMH42-siCul7治疗显著改善了视网膜的形态学变化,提高了光感受器的存活率,并恢复了部分视觉功能。这表明PEVsMH42-siCul7递送系统对视网膜变性具有显著的治疗效果。
五、作用机制探讨
为了深入探讨PEVsMH42-siCul7递送系统治疗视网膜变性的机制,研究团队进一步进行了机制研究。结果发现,PEVsMH42-siCul7诱导的Cul7下调能够防止Cul7介导的谷胱甘肽过氧化物酶4(Gpx4)泛素化和降解。Gpx4是一种重要的抗氧化酶,能够保护细胞免受氧化应激损伤。因此,PEVsMH42-siCul7通过抑制Cul7的表达,保护了Gpx4的活性,从而抑制了光感受器的铁死亡(Ferroptosis)。铁死亡是一种新型的细胞死亡方式,与氧化应激和脂质过氧化密切相关。因此,PEVsMH42-siCul7通过抑制光感受器的铁死亡,实现了对视网膜变性的有效治疗。
六、结论与展望
综上所述,本研究团队成功开发了一种光感受器靶向的细胞外囊泡递送系统(PEVsMH42-siCul7),该系统能够高效地将针对Cullin-7的siRNA递送至光感受器,并显著抑制Cul7的表达。通过抑制Cul7介导的Gpx4泛素化和降解,PEVsMH42-siCul7有效保护了光感受器免受氧化应激损伤和铁死亡的影响,从而实现了对视网膜变性的有效治疗。这一研究成果不仅为视网膜变性治疗提供了新的思路和方法,也为其他遗传性和退行性疾病的治疗提供了新的启示。
然而,尽管本研究取得了重要突破,但仍存在一些问题和挑战需要解决。例如,如何进一步优化PEVsMH42的制备和纯化工艺,提高其稳定性和生物利用度;如何确定不同患者群体中Cul7表达的差异,以实现个性化治疗;以及如何评估PEVsMH42-siCul7递送系统的长期安全性和有效性等。未来,研究团队将继续深入探索这些问题,以期为患者提供更加安全、有效的治疗方法。
此外,本研究也为细胞外囊泡在基因治疗中的应用提供了新的思路和方法。细胞外囊泡作为一种天然的纳米载体,具有高度的生物相容性和低免疫原性,能够高效地将治疗物质递送至目标细胞。因此,细胞外囊泡在基因治疗、药物递送和再生医学等领域具有广阔的应用前景。未来,随着技术的不断进步和研究的深入,细胞外囊泡有望在更多疾病的治疗中发挥重要作用。
总之,本研究团队通过开发光感受器靶向的细胞外囊泡递送系统(PEVsMH42-siCul7),成功实现了对视网膜变性的有效治疗。这一研究成果不仅为视网膜变性治疗提供了新的思路和方法,也为其他遗传性和退行性疾病的治疗提供了新的启示。未来,随着研究的深入和技术的不断进步,相信我们能够为患者提供更加安全、有效的治疗方法,为医学事业的发展做出更大的贡献。
| 名称 | 货号 | 规格 |
| CUL-7 (AB38) | sc-53810 | 200ug/ml |
| CUL-7 (H-8) | sc-514970 | 200ug/ml |