上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|血小板膜包裹的Alterbrassicene A纳米粒子通过抑制NF-κB P65磷酸化阻止主动脉瓣钙化
90 人阅读发布时间:2025-05-07 11:11
一、引言
主动脉瓣钙化(Calcific Aortic Valve Disease, CAVD)是一种日益普遍的心血管疾病,其发病率和死亡率均居高不下,成为导致心血管死亡和发病的主要原因之一。CAVD的病理生理过程涉及瓣膜纤维钙化和主动脉瓣间质细胞(Valve Interstitial Cells, VICs)中成骨和成纤维活动的增强。尽管近年来对CAVD的研究不断深入,但针对其发病机制的有效临床药物仍然匮乏。因此,探索新的治疗方法以阻止瓣膜钙化进程具有重要的临床意义。
近期,一项由某研究团队开展的研究揭示了血小板膜包裹的Alterbrassicene A(ABA)纳米粒子在抑制主动脉瓣钙化方面的潜力。这项研究不仅为CAVD的治疗提供了新的思路,还进一步丰富了我们对NF-κB信号通路在CAVD发病机制中作用的理解。以下是对该研究的详细解析。

二、研究方法
1. 细胞模型的建立
为了深入研究CAVD的发病机制,研究团队首先建立了永生化人主动脉瓣间质细胞(immortal human valve interstitial cells, im-hVICs)模型。通过pGMLV-SV40T-puro慢病毒感染,研究团队成功获得了具有稳定增殖能力的im-hVICs,为后续的实验提供了可靠的细胞来源。
2. 钙化评估与化合物筛选
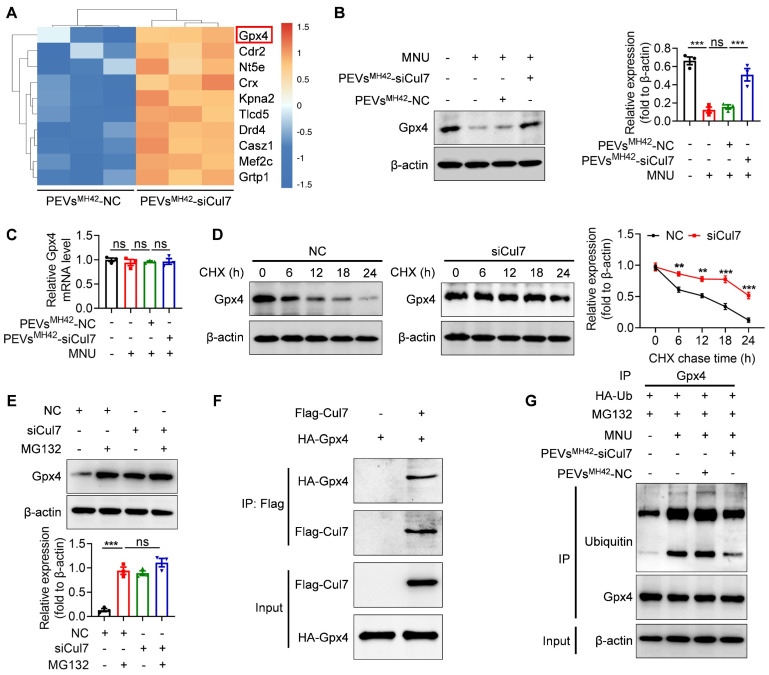
为了评估不同化合物对im-hVICs钙化的影响,研究团队采用了茜素红染色和Western blotting等方法。在筛选过程中,他们发现了一种具有潜在治疗功能的天然化合物——Alterbrassicene A(ABA)。ABA是一种来源于自然界的二萜类化合物,具有多种生物活性。
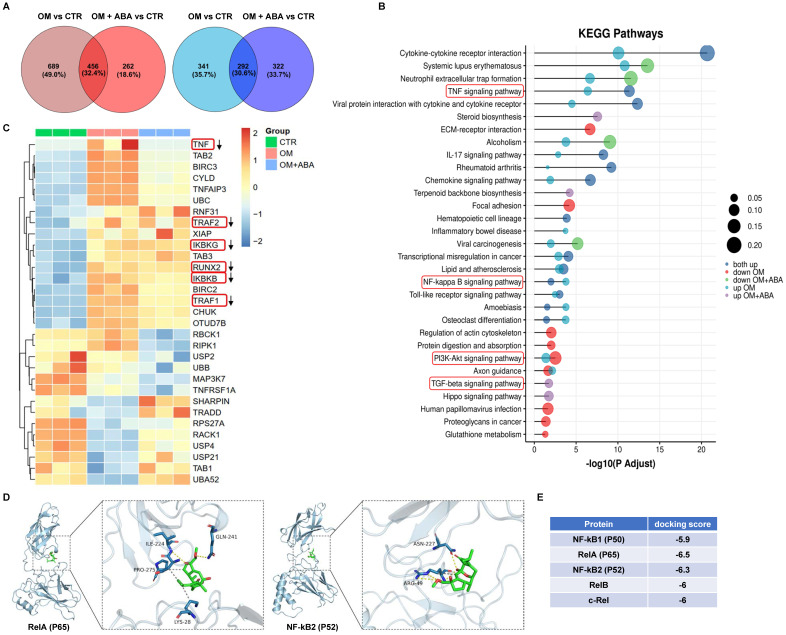
3. RNA测序与分子对接
为了深入了解ABA的作用机制,研究团队进行了RNA测序,以识别ABA的潜在靶点。测序结果显示,ABA能够显著影响NF-κB信号通路相关基因的表达。进一步地,分子对接实验揭示了ABA能够与NF-κB信号通路中的关键蛋白RelA(P65)结合。这一发现为ABA抑制CAVD提供了分子层面的解释。
4. 纳米粒子的制备与表征
为了提高ABA的生物利用度和靶向性,研究团队采用了血小板膜包裹技术,制备了血小板膜包裹的ABA纳米粒子(Platelet membrane-coated nanoparticle of ABA, PNP-ABA)。通过IBIDI泵等实验手段,他们评估了PNP-ABA的粘附能力和稳定性,为后续的动物实验奠定了基础。
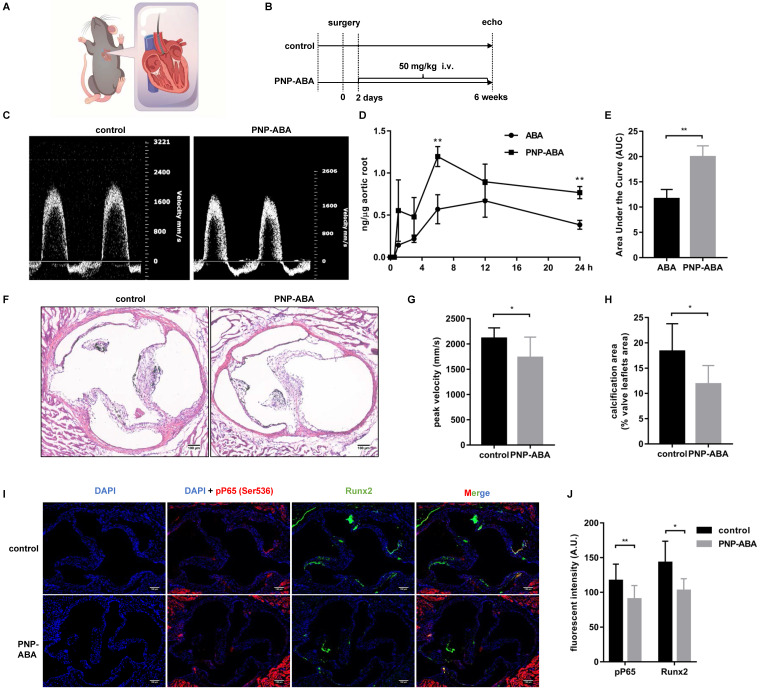
5. 动物实验与体内研究
为了验证PNP-ABA在体内的治疗效果,研究团队采用了小鼠钢丝诱导主动脉瓣狭窄模型进行体内研究。实验结果显示,PNP-ABA能够显著减轻小鼠主动脉瓣的钙化程度,进一步证实了其在CAVD治疗中的潜力。
三、研究结果
1. ABA抑制VICs钙化
研究团队发现,在成骨诱导条件下,ABA能够显著减少人VICs的钙化程度。这一作用是通过抑制NF-κB P65的磷酸化来实现的。ABA处理后的VICs中,Runx2和BMP2等成骨相关基因的表达水平显著下调,表明ABA能够抑制VICs的成骨分化。
2. ABA与P65蛋白的结合
分子对接实验结果显示,ABA能够与P65蛋白的特定区域结合,从而阻止其磷酸化和核转位。这一发现揭示了ABA抑制NF-κB信号通路的分子机制。
3. PNP-ABA的体内治疗效果
在小鼠钢丝诱导主动脉瓣狭窄模型中,PNP-ABA能够显著减轻主动脉瓣的钙化程度。这一结果表明,PNP-ABA在体内同样具有抑制瓣膜钙化的作用。此外,PNP-ABA还表现出良好的生物相容性和稳定性,为其在临床应用中的安全性提供了保障。
四、研究意义与讨论
1. 为CAVD治疗提供新思路
本研究揭示了ABA作为一种天然化合物在抑制主动脉瓣钙化方面的潜力。通过抑制NF-κB P65的磷酸化,ABA能够显著减少VICs的钙化程度,为CAVD的治疗提供了新的思路。此外,PNP-ABA的制备和应用进一步提高了ABA的生物利用度和靶向性,为其在临床应用中的推广奠定了基础。
2. 深化对NF-κB信号通路的理解
本研究还进一步加深了我们对NF-κB信号通路在CAVD发病机制中作用的理解。NF-κB信号通路作为一种重要的炎症和免疫调节通路,在多种疾病的发生和发展中发挥着重要作用。本研究发现ABA能够抑制NF-κB P65的磷酸化和核转位,从而阻止其下游炎症因子的释放和细胞增殖等生物学效应。这一发现不仅为CAVD的治疗提供了新的靶点,也为其他与NF-κB信号通路相关的疾病治疗提供了启示。
3. 展望与未来研究方向
尽管本研究取得了显著的成果,但仍存在一些需要进一步探索的问题。例如,ABA抑制NF-κB P65磷酸化的具体分子机制仍需深入研究;PNP-ABA在体内的代谢和排泄过程也需要进一步阐明。此外,为了将PNP-ABA推向临床应用,还需要进行更多的安全性和有效性评估实验。未来,研究团队将继续围绕这些问题开展深入研究,以期为CAVD的治疗提供更加有效的解决方案。
五、结论
本研究通过构建永生化人主动脉瓣间质细胞模型、筛选潜在治疗化合物、制备血小板膜包裹的纳米粒子以及进行体内外实验等手段,深入探讨了ABA在抑制主动脉瓣钙化方面的作用及其机制。研究结果显示,ABA能够显著减少人VICs的钙化程度,并通过抑制NF-κB P65的磷酸化来实现这一作用。此外,PNP-ABA在小鼠体内同样表现出良好的治疗效果和生物相容性。这些发现不仅为CAVD的治疗提供了新的思路和方法,也为我们深入理解NF-κB信号通路在心血管疾病中的作用提供了新的视角和启示。未来,随着研究的不断深入和技术的不断进步,我们有理由相信,PNP-ABA有望成为治疗CAVD的有效药物之一,为广大患者带来福音。
| 名称 | 货号 | 规格 |
| RUNX2 (D1H7) Rabbit mAb | 8486S | 100ul |
| RUNX2 (D1H7) Rabbit mAb | 8486T | 20μl |
| ALEXA FLUOR 647 DONKEY | A31571 | 1MG |
| ALEXA FLUOR 488 GOAT A | A11029 | 1MG |