上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|免疫组化检测HIP1R与Vimentin蛋白:预测IDH突变型胶质瘤中1p/19q缺失状态的有效手段
179 人阅读发布时间:2025-05-14 13:28
免疫组化检测HIP1R与Vimentin蛋白:预测IDH突变型胶质瘤中1p/19q缺失状态的有效手段
近期,一项关于利用蛋白质谱测序技术识别有效分子标志物,以预判IDH突变型胶质瘤中1p/19q缺失状态的临床研究,其结果已于2022年5月在影响因子为13.029的《Neuro-oncology》期刊上发表。该研究由德国海德堡大学的Marius Felix和David E. Reuss教授共同担任第一作者和通讯作者。

研究团队整合了来自海德堡大学医院和法兰克福大学医院神经病学研究所的两个队列,共计95例样本。他们利用timsTOFpro平台,从新鲜冰冻样本和石蜡样本中采集数据,并通过体外免疫组化检测进行了进一步验证。研究结果显示,通过检测HIP1R、vimentin和ATRX三种标志物的免疫组化表达,可以准确预测1p/19q的共缺失状态,其特异性高达100%,敏感性也达到了95%。
因此,研究者认为,这种方法为IDH突变型胶质瘤的分类提供了一种既简单又经济的手段。最后,作者还提出了一种易于在临床中广泛应用的、简便且可行的诊断1p/19q共缺失状态的流程。
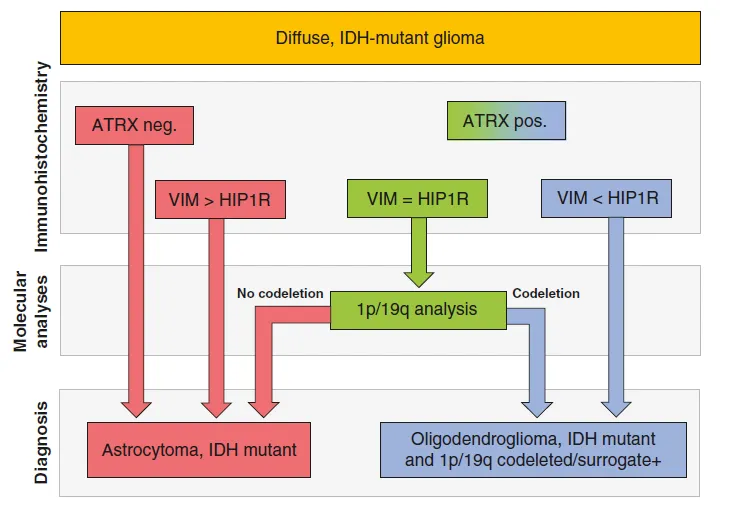
免疫组化分析HIP1R和Vimentin蛋白的表达水平可以用来预测IDH突变型胶质瘤中1p/19q染色体的缺失状态
研究背景
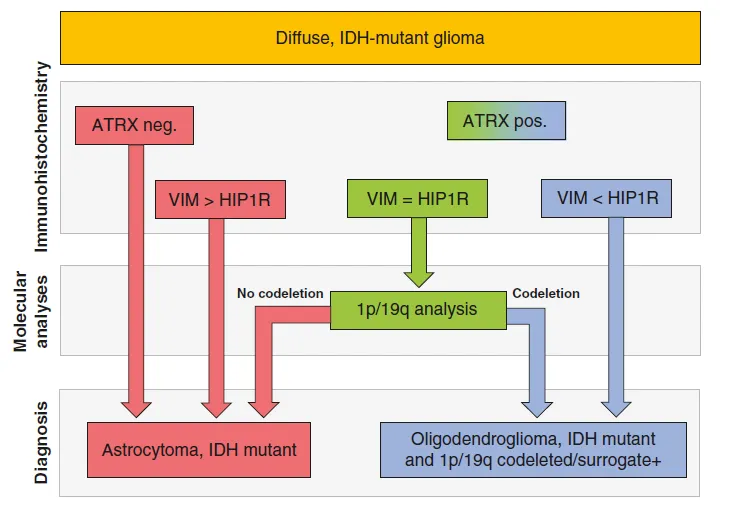
IDH突变型胶质瘤依据1p/19q染色体的共缺失情况,被划分为IDH突变1p/19q共缺失型少突胶质细胞瘤和IDH突变1p/19q非共缺失型星形细胞瘤。尽管细胞核中ATRX的缺失可以作为排除1p/19q共缺失的一个指标,但其敏感性有限,无法准确判断某些细胞核表达ATRX的胶质瘤的1p/19q状态。
研究方法
本研究对35例新鲜冷冻和72例石蜡包埋的胶质瘤样本进行了蛋白质质谱检测,旨在寻找能够预测1p/19q状态的潜在生物标志物。随后,在两个独立的队列中,包括77例IDH突变型伴1p/19q共缺失的少突胶质细胞瘤和92例IDH突变型星形细胞瘤,进行了免疫组化验证。
研究结果
通过质谱分析,研究者鉴定出了能够区分少突胶质细胞瘤和星形细胞瘤的高度特异性蛋白分子。具体而言,少突胶质细胞瘤高表达HIP1R(与亨廷顿蛋白相互作用的蛋白1相关蛋白),而低表达vimentin(波形蛋白);星形细胞瘤则表现出相反的表达模式。这一发现在35例石蜡包埋样本的免疫组化染色中得到了验证。进一步的双盲评价显示,利用HIP1R和vimentin的表达来预测1p/19q状态的准确性和特异性均非常高。在第一队列中,阳性和阴性预测值以及准确率均达到了100%;在第二队列中,阳性预测值为83%,阴性预测值为100%,准确率为92%。当结合星形细胞胶质瘤标记物ATRX的缺失时,敏感性提高到了96%,特异性则保持为100%。
研究结论
综上所述,研究者认为,通过免疫组化检测HIP1R、vimentin和ATRX可以准确预测1p/19q的共缺失状态,其特异性高达100%,敏感性也达到了95%。因此,这种方法为IDH突变型胶质瘤的分类提供了一种简单且经济的手段。
重要性
对1p/19q染色体状态的评估是区分IDH突变型星形细胞瘤和少突胶质细胞瘤的关键。然而,传统的基因测序方法不仅耗时较长,而且成本较高。目前,ATRX的免疫组化缺失是判断1p/19q非共缺失的唯一替代标记物。本研究利用质谱技术确定了HIP1R和vimentin的表达丰度作为新的候选生物标志物,并将其转化为免疫组化检测手段。在独立的验证队列中,超过90%的病例可以正确预测1p/19q的状态,同时结合ATRX的免疫组化检测,诊断敏感性也提高到了95%。此外,HIP1R/vimentin/ATRX方法的性能在另一个实验室分析的第二个独立验证队列中也得到了验证。因此,HIP1R、VIM和ATRX的联合免疫组化检测有望显著减少IDH突变型胶质瘤中归类为“未明确”诊断的病例数量。
前言
自2016年起,世界卫生组织要求将分子检测纳入少突胶质细胞瘤(具备IDH突变和1p/19q共缺失特征)及星形细胞瘤(具备IDH突变但1p/19q非缺失)的诊断体系中。IDH和1p/19q的状态对于疾病的诊断、预后评估及治疗策略的选择至关重要。IDH1-R132H突变的普遍性使得我们可以通过特异性抗体快速确定IDH状态,然而对于其他罕见的IDH突变,则需要进行测序。相比之下,1p/19q共缺失的检测则更为复杂,通常依赖于FISH分析、MLPA分析或基于测序数据的拷贝数分析。因此,寻找1p/19q的替代标记显得尤为重要。目前,虽然ATRX的缺失与IDH突变的星形细胞瘤高度相关,且可通过免疫组化轻松检测,但许多肿瘤并不表现出这一特征,导致IDH突变的敏感性降低。另一方面,TERT在IDH突变的少突胶质细胞瘤中会表现出启动子突变,但其检测需要DNA测序,尚未得到广泛应用。
本研究旨在通过质谱(MS)蛋白测序数据,分析IDH突变及1p/19q共缺失的少突胶质细胞瘤与IDH突变及1p/19q非共缺失的星形细胞瘤之间的差异,并探索将这些蛋白表达的差异转化为简单的免疫组化检测以确定1p/19q状态的可能性。
材料和方法
肿瘤组织来源
肿瘤组织样本来源于海德堡大学医院的神经病理学和神经外科部门,以及法兰克福大学医院神经病学研究所(Edinger研究所)的UCT生物样本库。样本和数据的收集均遵循当地伦理法规和批准。纳入标准为含有既往研究采集的Illumina人甲基化测序(450k)或Infinium甲基化EPIC(850k)测序数据的样本。所有肿瘤均由神经病理学家使用HE染色切片进行评估,以确保组织提取的准确性。部分患者的肿瘤样本同时出现在训练组和验证组中。所有队列的肿瘤均经过神经病理学家审查,并根据WHO 2016年标准给出综合诊断。
FF和FFPE组织质谱检测样品的制备
我们采用高效组织裂解和快速蛋白质消化的方法制备样品。在显微镜下对冷冻切片进行处理,确保肿瘤组织含量在70%以上。从FFPE组织块上选取合适的区域,使用活检打孔器获取肿瘤核心组织,并转移到EP管中进行进一步处理。
DDA模式的LC-MS/MS采集
采用Easy nLC 1200液相系统与timsTOFpro进行数据采集。多肽被负载在反液相柱上,采用流动相A和B进行肽分离。在DDA-PASEF模式下进行数据采集,包括MS1扫描和PASEF MS/MS扫描。离子积累和缓坡时间等参数均进行优化设置。
肽鉴定与数据分析
原始数据在MaxQuant环境中进行分析,并在人类Uniprot数据库中搜索。进行无标记定量,并使用R Studio进行后处理和统计分析。选择在新鲜冷冻组织或FFPE中90%以上的少突胶质细胞瘤或星形细胞瘤中发现的蛋白进行进一步分析。使用R包进行归一化、缺失值和下游差异表达分析。差异表达分析采用limma包和Benjamini-Hochberg方法进行FDR控制。同时,利用TCGA数据对VIM和HIP1R mRNA表达值进行log2转换并可视化。
免疫组化
在海德堡和法兰克福分别进行免疫组化染色。使用特定的抗体对石蜡包埋组织切片进行染色,并采用不同的染色仪和方案进行。切片由神经病理学家进行评估。
结果
FF和FFPE样品的蛋白质组学测序数据的可比性
在FF组织中,使用DDA-PASEF模式进行无标记蛋白质组定量,平均鉴定到大量独特的肽段和蛋白。在FFPE组织中,也获得了大量独特的多肽和蛋白质。来自同一肿瘤的FF和FFPE组织的pearson相关性较高,表明两者之间的蛋白质组学测序数据具有可比性。
星形细胞瘤和少突胶质细胞瘤间的差异蛋白
通过比较星形细胞瘤和少突胶质细胞瘤的MS数据,我们鉴定出了显著差异蛋白。其中,ATRX是两者之间差异最显著的蛋白之一。此外,在少突胶质细胞瘤中,HIP1R、TRIM67、SEZ6L和LRP4均显著上调;而在星形细胞瘤中,与编码基因1p/19q定位无关的上调蛋白主要是VIM、SYNM和TNC。
这些发现为我们后续将蛋白表达的差异转化为简单的免疫组化检测以确定1p/19q状态提供了重要依据。
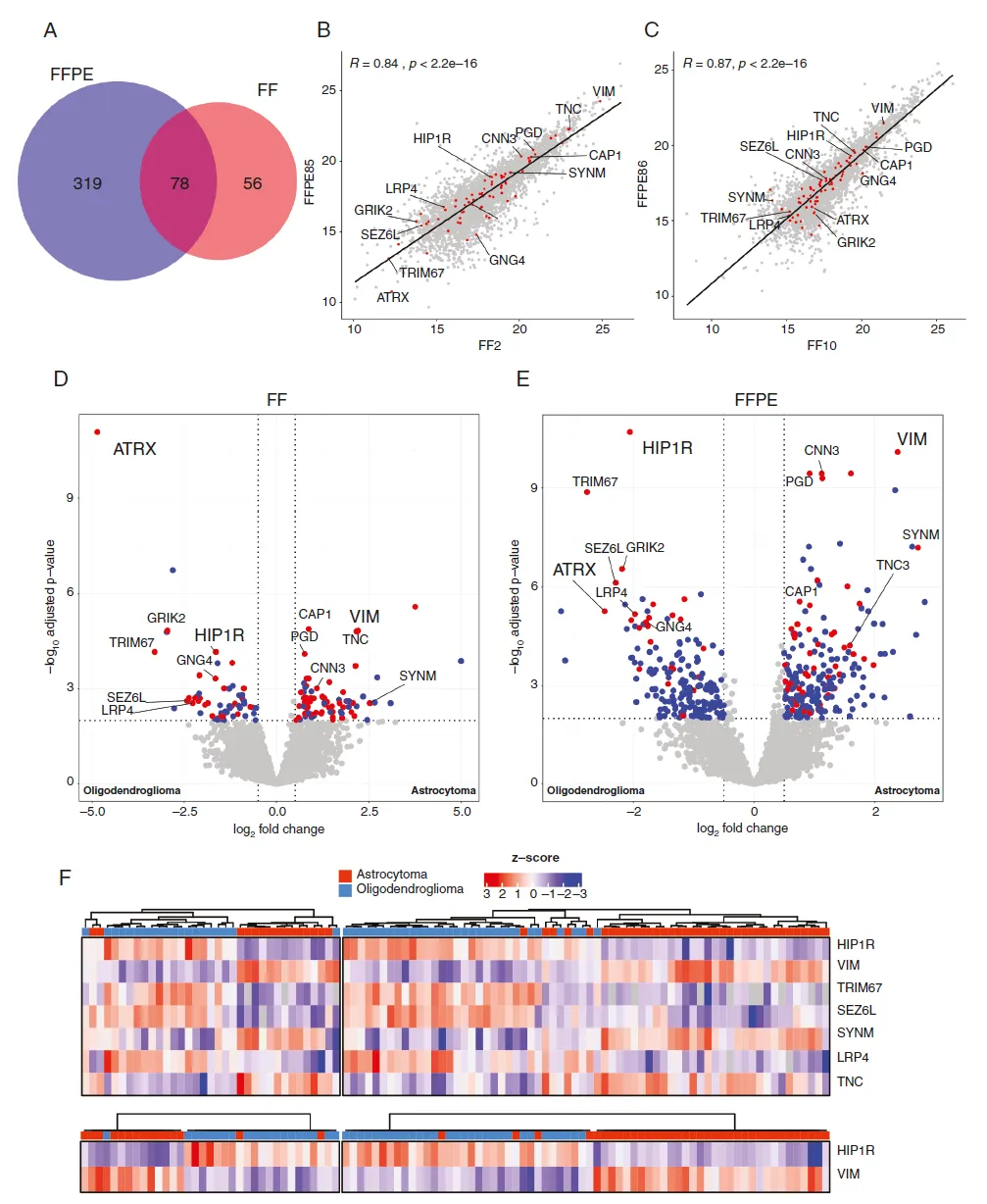
HIP1R和VIM在星形细胞瘤和少突胶质细胞瘤中的相反表达模式
通过对顶级差异丰度蛋白(HIP1R, TRIM67, SEZ6L, LRP4, VIM, SYNM, TNC)的蛋白丰度进行无监督层次聚类分析,我们可以有效地将少突胶质细胞瘤和星形细胞瘤区分开来,即使排除了已经建立的标记ATRX。在这些蛋白中,HIP1R、TRIM67、SEZ6L和LRP4的丰度模式与VIM、SYNM和TNC的丰度模式存在较大的重叠。然而,在进一步评估用于免疫组化检测的抗体后,我们发现并非所有蛋白都适合进行此类分析。例如,对于TRIM67,我们没有找到合适的抗体来获得满意的免疫组化染色;而VIM和TNC则提供了大量冗余信息。
因此,我们选择了HIP1R和VIM进行详细分析,因为它们提供了最一致的染色结果和聚类分析效果。仅使用HIP1R和VIM的丰度,我们就可以很好地将少突胶质细胞瘤和星形细胞瘤区分开来。值得注意的是,HIP1R和VIM在样本中的表达呈现出明显的相反模式,这种相反的表达模式与肿瘤类型密切相关。具体来说,37/38个HIP1R高丰度且VIM低丰度的样本为少突胶质细胞瘤,而38/39个VIM高丰度且HIP1R低丰度的样本为星形细胞瘤。少数VIM和HIP1R表达不相反的肿瘤既包括星形细胞瘤也包括少突胶质细胞瘤,但这一比例相对较低。
为了验证这一发现,我们使用了来自TCGA数据库的独立数据对mRNA水平进行了研究。结果表明,在IDH突变的胶质瘤中,无论是否存在1p/19q共缺失,HIP1R和VIM均存在反表达模式。这一发现进一步支持了HIP1R和VIM作为有用生物标志物的潜力。
综上所述,HIP1R和VIM在星形细胞瘤和少突胶质细胞瘤中的相反表达模式为我们提供了一种新的、潜在的生物标志物,有助于更准确地诊断这两种肿瘤类型。未来的研究将进一步探索这一发现的临床应用价值,并可能为胶质瘤患者的个性化治疗提供新的思路。
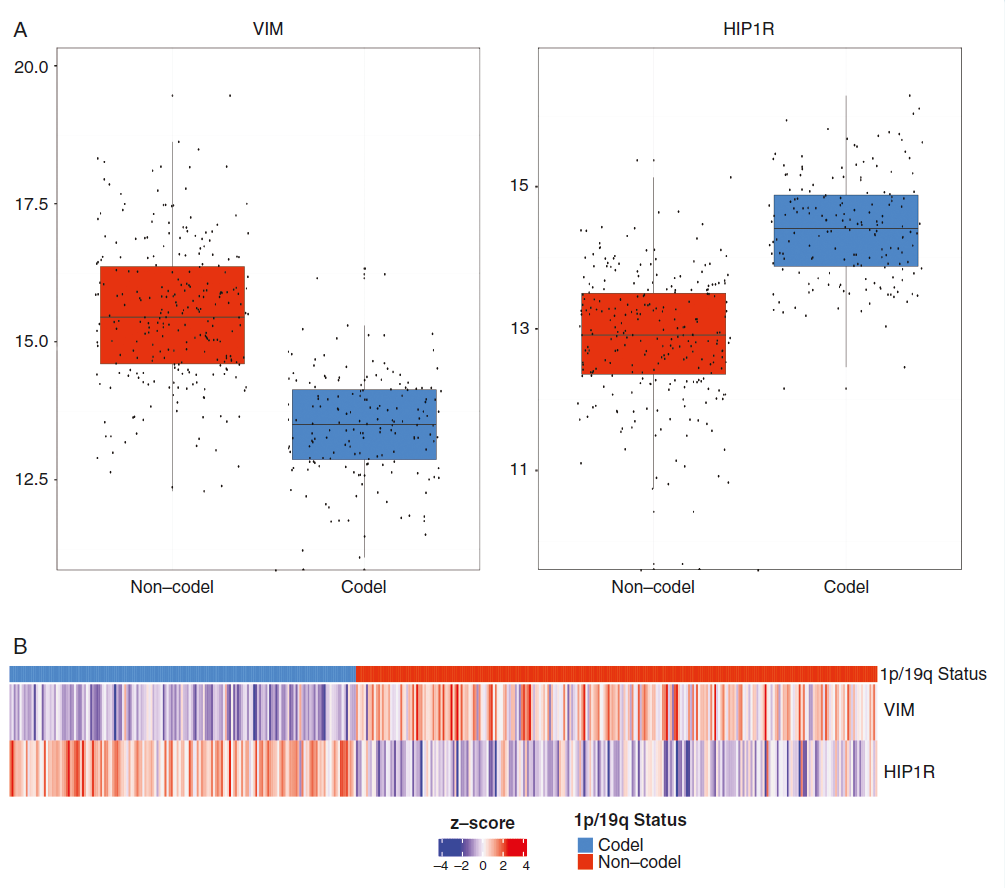
HIP1R和VIM的免疫组化表达模式分析
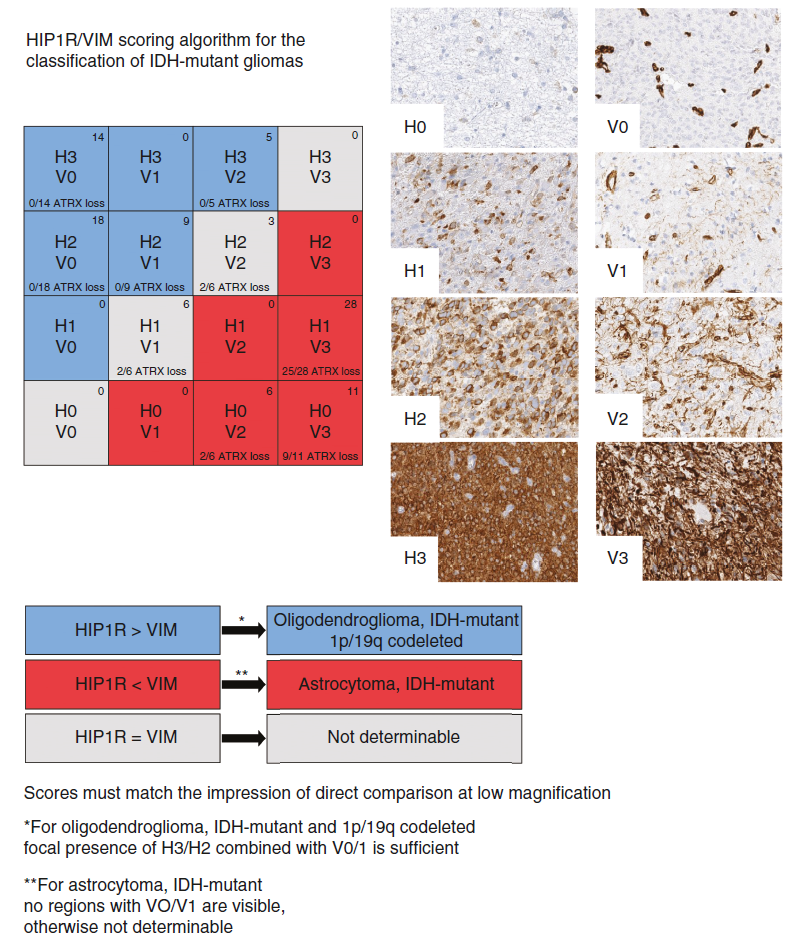
基于发现队列的肿瘤染色结果,我们为HIP1R和VIM分别定义了四个免疫组化表达水平(H0-3和V0-3),以更精确地描述它们在肿瘤细胞中的表达情况。
HIP1R的免疫组化表达模式
HIP1R主要表现出细胞质性和膜性阳性。其免疫组化评分定义如下:
- H0评分:当肿瘤细胞未结合抗体或仅有极少数细胞(<10%)呈现弱阳性时,给予H0评分。这表明HIP1R在肿瘤细胞中的表达极低或不存在。
- H1评分:代表肿瘤细胞多呈弱阳性,或中阳性细胞数量较少(10%-75%为阳性,但强阳性细胞少于30%)的情况。这表明HIP1R在部分肿瘤细胞中有一定表达,但强度不高。
- H2评分:当大于50%的肿瘤细胞为阳性,且大于30%的细胞显示强阳性时,但细胞排列不紧密,中间有空隙,或中度阳性肿瘤细胞密集排列形成弥漫性阳性区域(约100%中度阳性)时,给予H2评分。这表明HIP1R在大部分肿瘤细胞中有中等至高强度的表达。
- H3评分:当肿瘤细胞密集且强阳性,呈弥漫性阳性(强阳性约100%),仅血管呈阴性时,给予H3评分。这是HIP1R在肿瘤细胞中表达的最高水平。
值得注意的是,IDH1-R132H突变的少突胶质细胞瘤中,HIP1R抗体的分布模式与IDH1-R132H抗体相同,提示HIP1R仅在肿瘤细胞中表达。此外,HIP1R的肿瘤细胞特异性明显依赖于抗体滴定,因为较高的抗体浓度可能导致非肿瘤细胞的染色。
VIM的免疫组化表达模式
与HIP1R不同,VIM存在于广泛的细胞类型中,且总是与血管结合。其免疫组化评分定义如下:
- V0评分:当<10%的肿瘤细胞被标记,且仅血管或其他非肿瘤细胞呈阳性时,给予V0评分。这表明VIM在肿瘤细胞中的表达极低。
- V1评分:表示肿瘤中有10%-20%的肿瘤细胞及多个突起被标记。这表明VIM在部分肿瘤细胞中有一定表达。
- V2评分:当大约20%-70%的肿瘤细胞被标记时,包括许多进程,但有一部分(≥30%)肿瘤细胞为阴性时,给予V2评分。这表明VIM在大部分肿瘤细胞中有表达,但存在异质性。
- V3评分:当>70%的肿瘤细胞中度或强烈表达VIM时,导致肿瘤组织呈弥漫性阳性时,给予V3评分。这是VIM在肿瘤细胞中表达的最高水平。
在IDH野生型星形胶质细胞和轻脑膜结构中,VIM也呈阳性。由于VIM广泛存在于多种细胞类型中,因此分离肿瘤来源或反应来源的VIM表达似乎不可行。在典型形态的少突胶质瘤中,VIM与微小的芽状细胞和稀疏的纤维突有关,但难以指定一个特定的细胞体。
综上所述,HIP1R和VIM在肿瘤细胞中的免疫组化表达模式具有显著的差异和特征性,这为它们的临床诊断和病理学研究提供了重要依据。
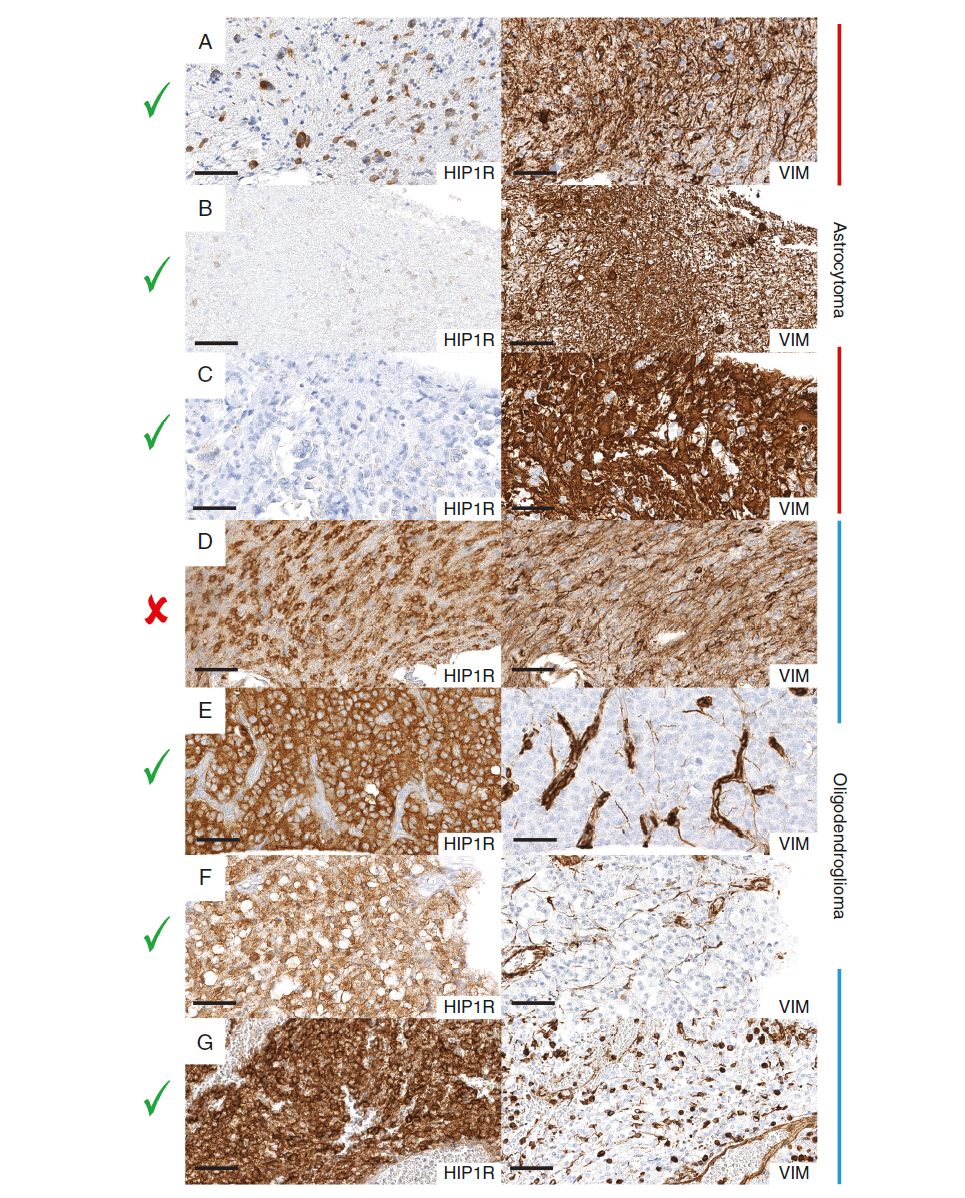
肿瘤类型特异性HIP1R/VIM表达模式发现系列分析
在肿瘤类型特异性HIP1R/VIM表达模式的研究中,我们采用了两位独立观察者的评估方法,对发现系列中的HIP1R和VIM表达模式进行了详细分析。以下是对该研究的总结:
一、HIP1R和VIM在肿瘤中的表达模式
- 少突胶质细胞瘤:
- HIP1R表达:中或高丰度(H2, H3)。
- VIM表达:缺乏(V0)或低水平(V1)。
- 星形细胞瘤:
- HIP1R表达:缺失(H0)或低水平(H1)。
- VIM表达:中度(V2)至高水平(V3)。
二、瘤内异质性
在部分样本中,我们观察到了瘤内异质性。具体表现为:
- 在某些区域,HIP1R高表达而VIM低表达。
- 在其他区域,HIP1R低表达而VIM高表达。
这种现象仅在少突胶质细胞瘤中观察到,并且在任何区域HIP1R的评分都达到了H2。VIM的频繁高表达可能与中枢神经系统(CNS)组织的浸润有关,而浸润细胞和反应细胞中缺乏IDH1-R132H的结合。
三、系统评估方法
为了对所有病例进行系统评估,我们采用了两级方法:
- 确定染色模式一致且HIP1R或VIM表达明显优势的病例:
- 这些病例代表了所有病例中的大多数,可以立即归因于少突胶质细胞瘤或星形细胞瘤。
- 识别具有异质染色模式或两种标记物表达不明确的病例:
- 在这些病例中,特别注意HIP1R表达最强的区域。
- 如果HIP1R在这些区域的表达强于VIM,则归类为少突胶质细胞瘤。
- 即使肿瘤局部存在大量VIM阳性的小分裂细胞,只要同一肿瘤的其他区域VIM的表达要少得多,也可以被划分为少突胶质细胞瘤。
四、模糊病例的处理
在少数评分结果比较模糊的病例中,我们在低倍镜下(10-20倍)直接比较HIP1R和VIM的免疫反应,并根据优势染色进行肿瘤分类。如果HIP1R占主导地位,则调整VIM的评分;如果VIM占主导地位,则同样调整HIP1R的评分。只要肿瘤的任何区域不存在低水平的VIM表达,VIM强度的优势就提示为星形细胞瘤。在强度相等的情况下,则无法做出决定。
五、图形化算法
为了更直观地展示这一评估过程,我们提供了作为图形化算法。该算法清晰地展示了如何根据HIP1R和VIM的表达模式对肿瘤进行分类。
综上所述,HIP1R和VIM的免疫组化表达模式在少突胶质细胞瘤和星形细胞瘤中具有显著的差异和特征性。通过系统的评估方法和图形化算法,我们可以更准确地诊断这两种肿瘤类型,并为患者的个性化治疗提供新的思路。
HIP1R在少突胶质瘤样细胞中的表达模式分析
在探究HIP1R在少突胶质瘤样细胞中的表达模式时,我们特别关注了其在少突胶质细胞瘤(尤其是具有典型“蜂窝状”形态的肿瘤)中的表现。已知HIP1R在少突胶质细胞瘤中呈现强弥漫阳性,这为我们提供了一个参考标准。
然而,当我们转而研究组织学模拟IDH野生型肿瘤时,发现这些肿瘤并未显示出与少突胶质细胞瘤相似的HIP1R表达模式。具体来说,我们分析了10例具有少突样特征的IDH野生型肿瘤,这些肿瘤包括GBM-O(4例)、透明细胞室管膜瘤(2例)、DLGNT(2例)和PLYNT(1例)。在这些肿瘤中,HIP1R的表达模式与少突胶质细胞瘤存在显著差异。
在IDH野生型肿瘤中,HIP1R的表达呈现出阴性或阳性但核周晕不受影响的特点。具体来说,这些肿瘤的肿瘤细胞核周晕区域要么完全不受HIP1R免疫阳性的影响,要么只是部分受影响。这与少突胶质瘤中核周晕呈现强烈弥漫胞浆HIP1R染色的特点形成了鲜明对比。
这一发现表明,尽管某些IDH野生型肿瘤在组织学上可能模拟少突胶质细胞瘤的特征,但它们在HIP1R的表达模式上却存在显著差异。因此,HIP1R的免疫组化染色可以作为区分少突胶质细胞瘤和IDH野生型肿瘤的一个重要工具。
综上所述,HIP1R在少突胶质瘤样细胞中的表达模式具有特异性,其强弥漫阳性的特点有助于我们识别真正的少突胶质细胞瘤,并与组织学模拟但HIP1R表达模式不同的IDH野生型肿瘤进行区分。这一发现为肿瘤的诊断和分类提供了新的线索和依据。
讨论
在医学诊断领域,提高诊断方法的敏感性、特异性和简洁性一直是追求的目标。对于IDH突变型胶质瘤的诊断,本研究通过探索HIP1R/VIM/ATRX三标记免疫组化方法,为准确预测1p/19q状态提供了一种新的策略。
在探索过程中,我们采用了多维的复杂步骤,包括两名独立观察者对大量样本进行双盲评价,以及在不同实验室间进行验证等,以确保结果的可靠性和可重复性。通过这些复杂的步骤,我们最终得到了一个简单而有效的诊断方法。
IDH突变型胶质瘤的蛋白组学研究进一步支持了我们的发现。运用LC-MS/MS技术,我们能够特异性地鉴别出IDH突变的星形细胞瘤和少突胶质细胞瘤,以及他们之间的1p/19q共缺失状态。这一结果与我们的免疫组化结果高度一致,表明了LC-MS/MS分析在胶质瘤诊断中的潜力和价值。
在差异蛋白的分析中,我们发现ATRX、HIP1R和VIM在IDH突变的胶质瘤中具有特定的表达模式。ATRX在星形细胞瘤中常呈现缺失状态,而HIP1R和VIM在少突胶质细胞瘤和星形细胞瘤中的表达强度相反。这些发现为我们利用这些标记物进行胶质瘤分类和预测1p/19q状态提供了理论基础。
值得注意的是,尽管我们的方法具有很高的敏感性和特异性,但仍存在一定的局限性。例如,在肿瘤细胞含量较少的区域,该检测方法的准确性可能会下降。此外,该方法仅适用于经典的IDH突变型胶质瘤,而不适用于某些变异的胶质瘤类型。因此,在实际应用中,我们需要结合患者的临床信息和其他诊断手段进行综合判断。
结论
本研究通过LC-MS/MS技术和免疫组化方法,证明了HIP1R/VIM/ATRX三标记方法在预测IDH突变型胶质瘤的1p/19q状态方面具有高度的敏感性和特异性。该方法不仅降低了评估与WHO诊断IDH突变型胶质瘤相关的参数的技术复杂性,还为胶质瘤的精准诊断和治疗提供了新的思路。未来,我们将继续探索和优化该方法,以期在胶质瘤的临床诊断和治疗中发挥更大的作用。同时,我们也期待更多的研究者加入到这一领域的研究中来,共同推动胶质瘤诊断和治疗的发展。
| 名称 | 货号 | 规格 |
| Recombinant Human Vimentin Protein | abs01285-100ug | 100ug |
| Vimentin (D21H3) XP ® Rabbit mAb | 5741T | 20ul |
| PE Mouse Anti-Human Vimentin(RV202) | 562337 | 50Tst |
| Vimentin (RV202) | sc-32322 | 200ug/ml |



































