上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|李珊珊/余希岚合作揭示代谢调控自噬的新机制
156 人阅读发布时间:2025-05-22 14:05
引言
自噬作为一种保守的分解代谢过程,在细胞稳态维持和存活中起着至关重要的作用。它不仅能够分解细胞质成分、异常蛋白质和功能失调的细胞器,还能回收内源性大分子,实现资源的重复利用。然而,自噬功能的缺失或紊乱与多种人类疾病的发生和发展密切相关,包括癌症、神经退行性病变、肌肉疾病和衰老等。因此,深入探究自噬的调控机制,对于理解这些疾病的发病机理以及开发潜在的治疗策略具有重要意义。
近年来,随着表观遗传学和代谢调控研究的不断深入,科学家们逐渐认识到自噬过程受到复杂的分子网络调控。其中,组蛋白修饰作为一种重要的表观遗传调控方式,在自噬基因的转录调控中发挥着关键作用。然而,关于组蛋白去乙酰化酶和组蛋白乙酰化如何同时抑制自噬基因转录的看似矛盾的现象,一直是该领域亟待解决的重要问题。
近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室的李珊珊教授和余希岚教授合作,在Science Advances杂志上发表了题为“The TORC1 activates Rpd3L complex to deacetylate Ino80 and H2A.Z and repress autophagy”的研究论文。该研究通过揭示Rpd3L复合物在代谢调控自噬中的新机制,完美解释了上述矛盾现象,为自噬调控的研究提供了新的视角和思路。

一、自噬及其调控机制概述
自噬是一种广泛存在于真核细胞中的分解代谢过程,通过溶酶体降解细胞质成分、异常蛋白质和功能失调的细胞器,维持细胞稳态和存活。自噬过程受到严格调控,包括转录水平、转录后水平、翻译和翻译后修饰水平等多个层面。其中,转录水平调控是自噬调控的重要一环。
许多自噬相关基因在营养缺乏条件下,其转录被显著诱导,从而增强自噬效率。这种诱导机制涉及多种信号通路和分子机制,如TOR(雷帕霉素靶蛋白)信号通路、PKA(蛋白激酶A)信号通路等。然而,关于自噬相关基因的转录调控机制,尤其是组蛋白修饰在其中的作用,仍有许多未知待解。
二、组蛋白修饰与自噬调控
组蛋白修饰作为一种重要的表观遗传调控方式,在基因转录调控中发挥着关键作用。其中,组蛋白乙酰化和去乙酰化是两种重要的修饰方式,它们通过影响染色质结构和DNA可及性,进而调控基因转录。
关于组蛋白修饰在自噬调控中的作用,已有一些研究报道。例如,H2B单泛素化(H2Bub1)通过控制自噬相关基因的转录来激活自噬;乙酰转移酶hMOF催化的H4K16ac也参与自噬调节。此外,李珊珊课题组之前的研究发现,丙酮酸激酶通过磷酸化组蛋白H3T11抑制自噬相关基因的转录,而营养感知器PKA则通过调控H3K4去甲基化激活自噬基因的表达。
然而,关于组蛋白去乙酰化酶Rpd3L复合物在自噬调控中的作用,一直存在争议。已知Rpd3L复合物抑制自噬基因的转录,使自噬维持在较低的水平。然而,组蛋白乙酰化升高也被报道抑制自噬基因转录。这种看似矛盾的现象,使得Rpd3L复合物在自噬调控中的具体作用机制成为该领域亟待解决的重要问题。
三、Rpd3L复合物在代谢调控自噬中的新机制
为了解决上述问题,李珊珊教授和余希岚教授合作,通过一系列精心设计的实验,揭示了Rpd3L复合物在代谢调控自噬中的新机制。
- Rpd3L复合物的新靶点鉴定
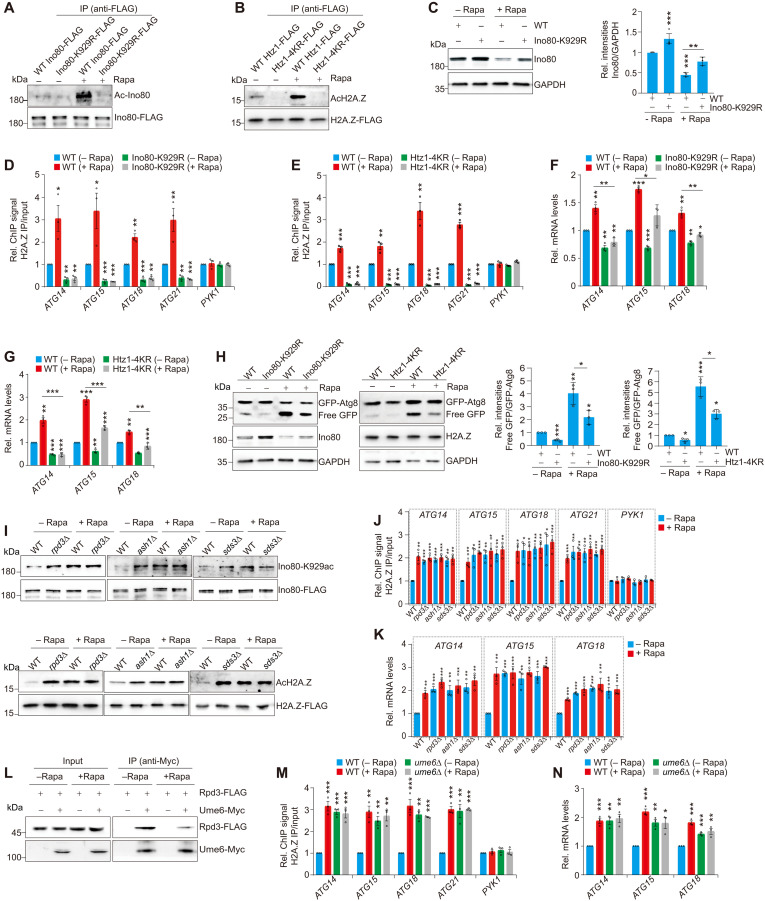
研究人员首先排除了Rpd3L通过去乙酰化组蛋白来抑制自噬基因转录的可能性。然后,通过蛋白质纯化结合质谱技术,他们发现染色质重塑复合物INO80是Rpd3L复合物的新靶点。Rpd3L可以与INO80复合物的多个亚基相互作用,负调控自噬相关基因的转录。
进一步研究发现,Rpd3L可特异性催化INO80催化亚基Ino80的去乙酰化,且去乙酰化位点为K929。这一发现揭示了Rpd3L复合物在自噬调控中的新作用机制,即通过去乙酰化INO80来抑制自噬基因的转录。
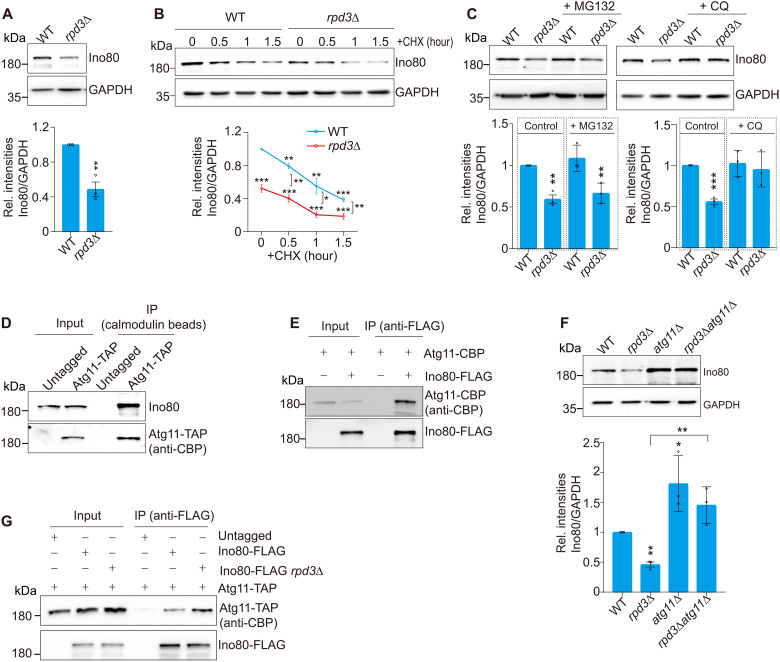
- Ino80去乙酰化对自噬的调控
有趣的是,Rpd3L催化的Ino80 K929去乙酰化对于Ino80的蛋白稳定性非常重要。敲除Rpd3后,Ino80的乙酰化水平升高,进而被自噬降解。这表明Rpd3L复合物可以保护染色质重塑蛋白Ino80免受自噬降解,从而维持其稳定表达。
去乙酰化的Ino80将组蛋白变体H2A.Z从自噬相关基因启动子处驱逐,从而抑制自噬基因的转录。这一发现进一步证实了Rpd3L复合物通过去乙酰化INO80来抑制自噬基因的转录的调控机制。
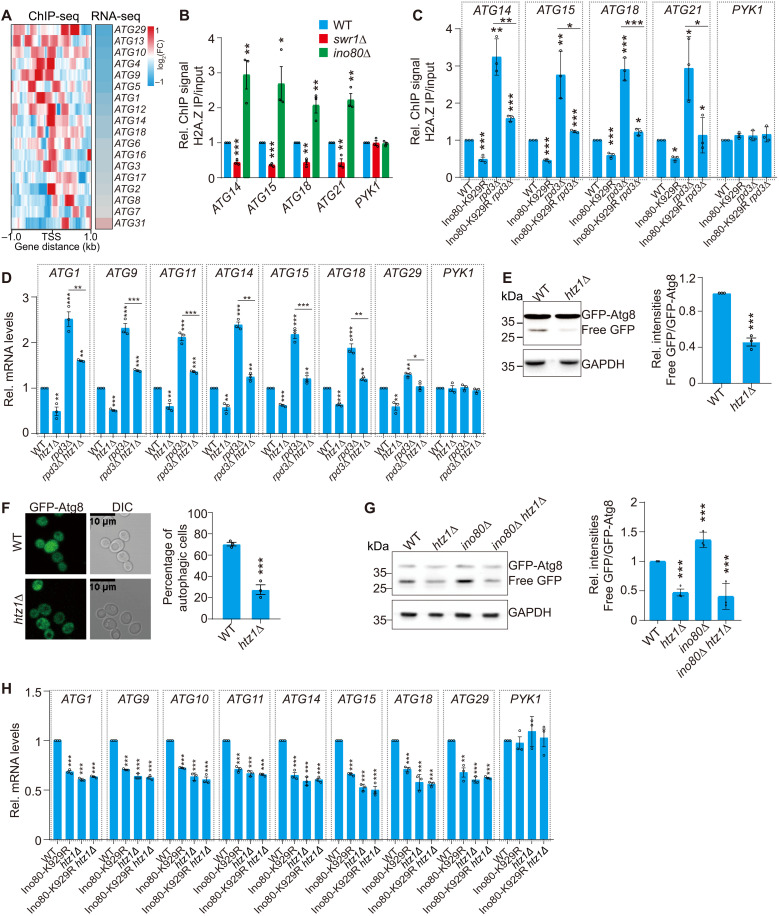
- H2A.Z去乙酰化对自噬的调控
除了INO80之外,Rpd3L还可去乙酰化组蛋白变体H2A.Z。Rpd3L可催化H2A.Z K3、8、10和14的去乙酰化,减少其整合进自噬基因的启动子区域,从而抑制自噬基因的转录。这使得自噬在营养丰富的条件下保持在较低水平。
研究还发现,H2A.Z不仅可以正调控自噬基因转录,而且其乙酰化可进一步促进自噬基因的转录。这表明H2A.Z的乙酰化状态是影响自噬基因转录的重要因素之一。
- 营养感知器mTOR对Rpd3L活性的调控
为了探究细胞如何通过调控Rpd3L催化的INO80与H2A.Z的去乙酰化来响应外界营养变化,研究人员进一步筛选了影响Rpd3L活性的因子。他们发现,营养感知器mTOR可激活Rpd3L的酶活性。
当细胞在富含营养的条件下生长时,TORC1(mTOR复合体1)被激活,通过磷酸化下游的Rim15使其失活,从而促进Rpd3去乙酰化INO80和H2A.Z。这最终抑制了自噬基因的转录,确保在营养丰富时细胞基础自噬水平较低。
相反,当细胞在饥饿条件下时,TORC1失活,Rim15被转运到细胞核中磷酸化Rpd3L,导致Rpd3L复合物的解离和失活。这使得INO80的乙酰化水平增加并被自噬降解,同时H2A.Z的乙酰化水平也升高。乙酰化的H2A.Z在自噬基因启动子区域的结合增多,从而诱导自噬基因的转录。
四、结论与展望
综上所述,李珊珊教授和余希岚教授合作的研究揭示了Rpd3L复合物在代谢调控自噬中的新机制。他们通过寻找Rpd3L去乙酰化靶点,鉴定出新的自噬调控因子INO80和H2A.Z,并发现了调控染色质重塑复合物活性的新方式。更重要的是,该研究证明了Rpd3L抑制自噬相关基因的转录是通过去乙酰化INO80而不是核心组蛋白,从而解释了领域中组蛋白去乙酰化酶和组蛋白乙酰化均可抑制自噬这一看似矛盾的现象。
此外,该研究还创新性地将营养物质的感知、染色质重塑和基因转录有机地联系起来,揭示了代谢调控自噬的表观遗传机制。这一发现不仅为自噬调控的研究提供了新的视角和思路,也为理解相关疾病的发病机理以及开发潜在的治疗策略提供了重要的理论依据。
未来,随着研究的深入,我们有望进一步揭示自噬调控的复杂网络,为相关疾病的预防和治疗提供更多的可能性。同时,该领域的研究也将促进表观遗传学和代谢调控等领域的交叉融合,推动生物医学研究的不断进步。
| 名称 | 货号 | 规格 |
| Acetylated-Lysine Antibody | 9441S | 100ul |
| Acetylated-Lysine Antibody | 9441L | 300ul |
| Rpd3 (G-9) | sc-514160 | 200ug/ml |
| CALCRL:RAMP3-CRE-BLA FS 293F C | K1439 | COMBO |