上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|NAT10/ac4C/JunB轴驱动三阴性乳腺癌恶性进展与免疫抑制的新机制
99 人阅读发布时间:2025-05-23 13:44
引言
三阴性乳腺癌(Triple-Negative Breast Cancer, TNBC)作为乳腺癌的一种亚型,以其高度侵袭性、化疗耐药性和缺乏有效的靶向疗法而著称,占所有乳腺癌病例的约15%-20%。TNBC患者通常预后较差,五年生存率显著低于其他类型的乳腺癌。近年来,尽管免疫治疗,特别是针对程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)的单克隆抗体,在多种肿瘤治疗中取得了显著进展,但在TNBC中的疗效仍然有限。因此,深入探索TNBC的发病机制,寻找新的治疗靶点,对于改善TNBC患者的预后具有重要意义。
近期,一篇发表在《Journal of Experimental & Clinical Cancer Research》(JECCR)上的研究论文《NAT10/ac4C/JunB facilitates TNBC malignant progression and immunosuppression by driving glycolysis addiction》揭示了NAT10/ac4C/JunB轴在驱动TNBC恶性进展和免疫抑制中的重要作用,为TNBC的治疗提供了新的思路。

研究背景与目的
乳腺癌是女性最常见的癌症,其发病率和死亡率均居高不下。TNBC由于缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达,使得传统的内分泌治疗和抗HER2靶向治疗对其无效。因此,TNBC的治疗主要依赖于化疗和免疫治疗,但疗效有限,且易产生耐药。
近年来,随着对肿瘤免疫微环境(TME)和肿瘤代谢研究的深入,人们逐渐认识到TME的复杂性和肿瘤代谢的多样性在肿瘤进展和免疫治疗中的作用。特别是,肿瘤细胞的糖酵解代谢与免疫抑制之间的关系备受关注。本研究旨在探讨NAT10如何通过调控ac4C修饰和JunB表达,促进TNBC的恶性进展和免疫抑制,以及这一机制在糖酵解依赖中的作用。
研究方法
-
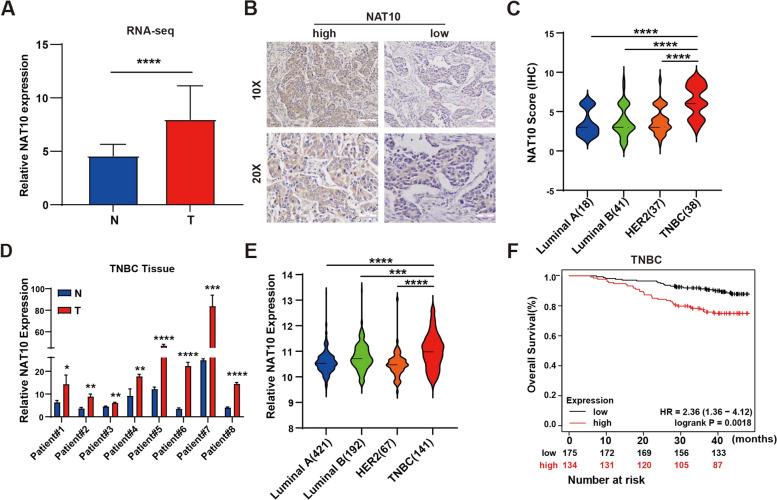
临床样本分析:研究团队首先收集了TNBC患者的临床样本,包括肿瘤组织和正常组织,通过mRNA和蛋白质水平检测NAT10的表达,并与正常组织进行比较。同时,测量了TNBC样本中ac4C修饰的水平。
-
体外和体内实验:利用TNBC细胞系进行体外实验,包括增殖、侵袭和迁移实验,以及RNA-seq和ChIP-seq等分子生物学实验,探究NAT10对TNBC细胞生物学行为的影响。同时,构建小鼠肿瘤模型进行体内实验,验证NAT10在TNBC进展中的作用。
-
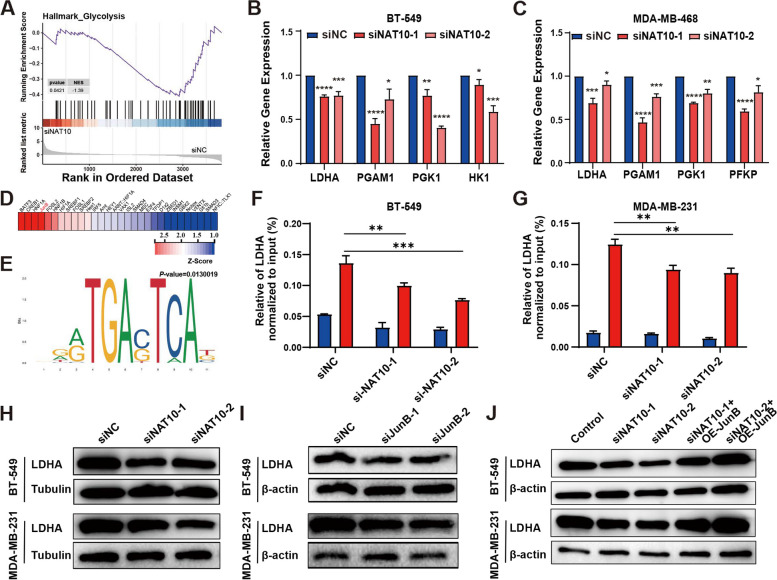
机制探索:通过RNA-seq和生物信息学分析,揭示NAT10调控TNBC恶性进展和免疫抑制的分子机制。特别是,通过敲低NAT10表达,观察对JunB表达和糖酵解代谢的影响。
-
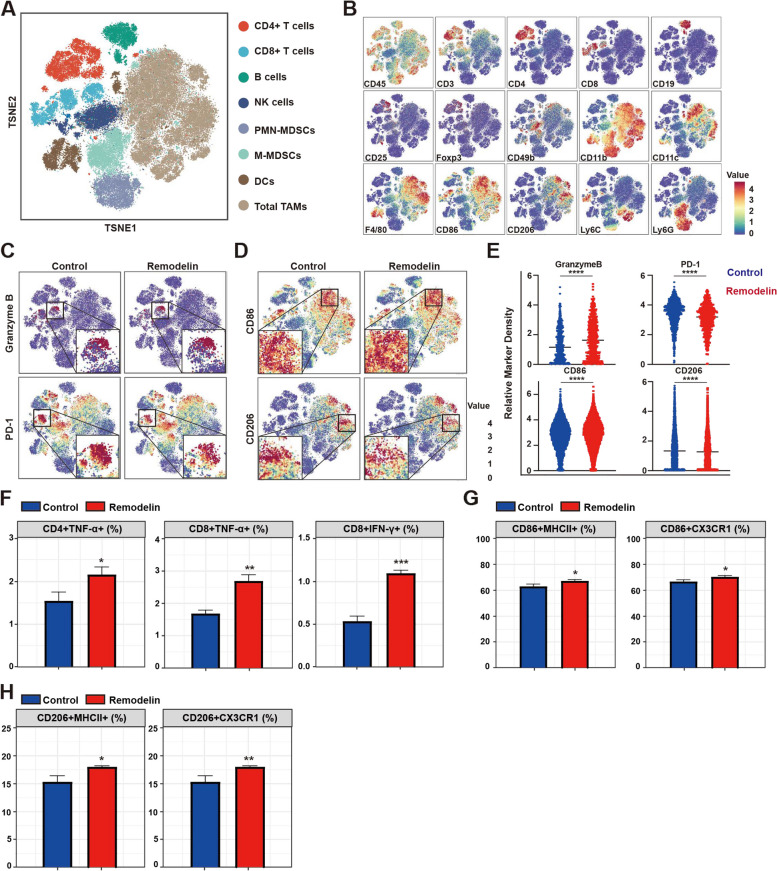
联合治疗探索:基于NAT10在TNBC免疫逃逸中的作用,研究团队探索了靶向NAT10的抑制剂remodelin与CTLA-4单克隆抗体联合治疗TNBC的潜力。
研究结果
-
NAT10在TNBC中高表达且与预后不良相关:研究团队发现,NAT10在TNBC组织中的表达显著高于正常组织,且其高表达与TNBC患者的预后不良密切相关。这一结果提示NAT10可能是TNBC的一个重要致癌基因。
-
NAT10促进TNBC进展和免疫抑制:体外和体内实验均表明,敲低NAT10表达可以显著抑制TNBC细胞的增殖、侵袭和迁移能力,同时促进T细胞激活和重塑TME。这些结果揭示了NAT10在促进TNBC进展和免疫抑制中的关键作用。
-
NAT10通过上调JunB表达促进糖酵解:机制研究表明,NAT10通过增加ac4C修饰水平上调JunB的表达,进而促进糖酵解关键酶LDHA的表达和糖酵解代谢。这一发现揭示了NAT10/ac4C/JunB轴在驱动TNBC糖酵解依赖中的重要作用。
-
联合治疗提高疗效:研究团队进一步探索了靶向NAT10的抑制剂remodelin与CTLA-4单克隆抗体联合治疗TNBC的潜力。结果显示,联合治疗可以显著抑制肿瘤进展,同时促进免疫细胞浸润,提高疗效。
研究意义与讨论
本研究首次揭示了NAT10/ac4C/JunB轴在驱动TNBC恶性进展和免疫抑制中的重要作用,为TNBC的治疗提供了新的思路。特别是,通过靶向NAT10,可以抑制TNBC的糖酵解代谢,促进T细胞激活,重塑TME,从而提高免疫治疗的疗效。
此外,本研究还揭示了糖酵解代谢与免疫抑制之间的密切关系。肿瘤细胞通过糖酵解代谢产生大量乳酸,营造酸性TME,抑制免疫细胞的活性和功能。而靶向NAT10可以抑制糖酵解代谢,从而降低乳酸产生,改善TME,促进免疫细胞浸润和激活。
然而,本研究也存在一些局限性。例如,remodelin对T细胞和巨噬细胞糖酵解水平的影响未进行深入研究;NAT10如何影响其他细胞因子或因子分泌,进而影响巨噬细胞激活的机制也未明确。这些问题有待于进一步研究。
结论与展望
综上所述,本研究揭示了NAT10/ac4C/JunB轴在驱动TNBC恶性进展和免疫抑制中的重要作用,为TNBC的治疗提供了新的思路。通过靶向NAT10,可以抑制TNBC的糖酵解代谢,促进T细胞激活,重塑TME,从而提高免疫治疗的疗效。未来,将进一步研究NAT10在TNBC中的其他作用机制,以及探索更多针对NAT10的靶向疗法,为TNBC患者带来更好的治疗效果和预后。
同时,本研究也提示我们,肿瘤代谢与免疫微环境之间的相互作用是肿瘤进展和治疗的重要方面。未来,将深入研究肿瘤代谢与免疫微环境之间的相互作用机制,为肿瘤的治疗提供新的思路和方法。相信随着研究的深入和技术的进步,TNBC的治疗将取得更大的突破和进展。