上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析Nlrp6通过调节RIG-1/MAVS介导的自噬保护神经干细胞免受皮质酮诱导的铁死亡
150 人阅读发布时间:2025-07-03 13:13
一、研究背景与重要性
在神经科学领域,成年期神经干细胞的持续增殖与分化对于维持大脑功能至关重要。然而,这些细胞极易受到各种应激刺激的影响,如压力激素皮质酮(CORT),从而导致神经生成下降,并最终可能引发认知缺陷。近年来,越来越多的研究开始关注铁死亡(ferroptosis)这一新型细胞死亡方式在神经退行性疾病中的作用。铁死亡是一种由脂质过氧化驱动的、铁依赖的细胞死亡方式,它在神经细胞的损伤与死亡中扮演着重要角色。
本研究的焦点在于探讨NOD样受体家族含吡喃结构域蛋白6(Nlrp6)在保护海马神经干细胞(NSPCs)免受皮质酮诱导的铁死亡中的作用。Nlrp6作为一种在NSPCs中高表达的蛋白,先前的研究已显示其在维持海马神经生成以抵抗应激诱导的抑郁中起着关键作用。然而,其具体的分子机制尚不清楚。本研究通过深入探究Nlrp6在调节铁死亡过程中的作用,为理解神经干细胞的应激反应提供了新的视角,并为神经退行性疾病的治疗提供了新的潜在靶点。

二、实验设计与方法
为了揭示Nlrp6在NSPCs中的保护作用,研究者们设计了一系列巧妙的实验。首先,他们利用基因敲除技术构建了Nlrp6缺失的小鼠模型,并观察了这些小鼠在认知功能和海马神经干细胞数量上的变化。结果显示,Nlrp6缺失导致小鼠出现认知缺陷和海马NSPCs数量减少。
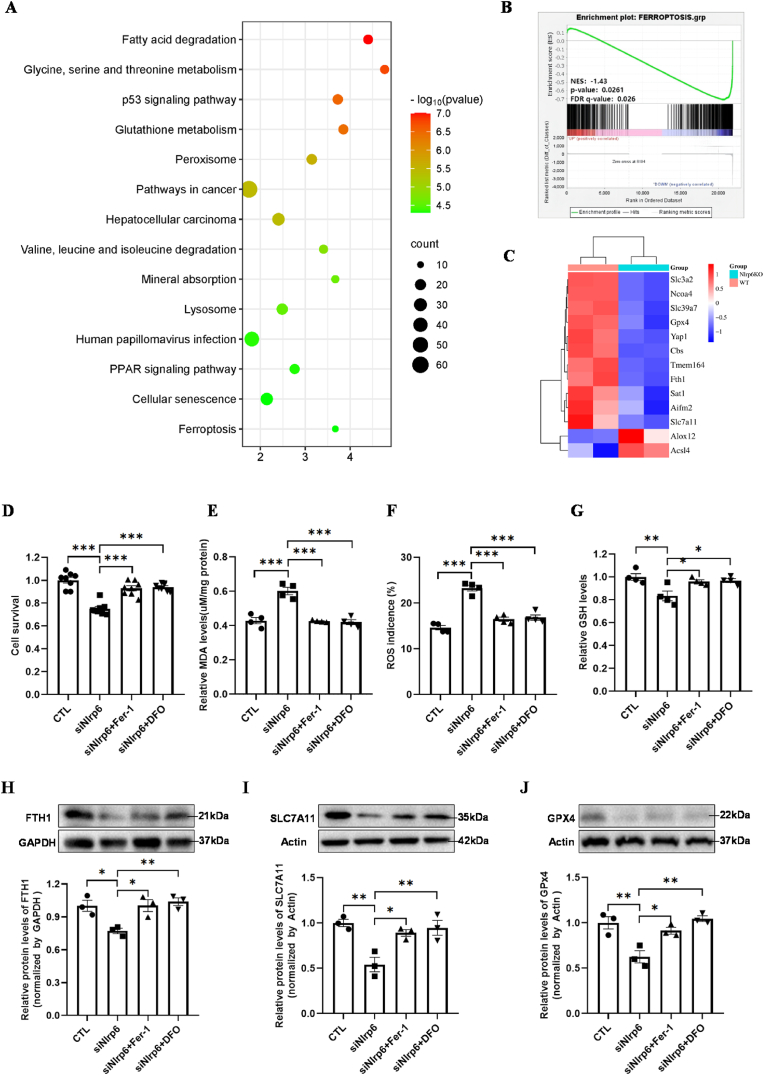
接下来,研究者们对原代NSPCs进行了RNA测序分析,以探究Nlrp6缺失对线粒体能量生成和铁死亡过程基因表达谱的影响。他们发现,Nlrp6缺失会显著改变这些基因的表达,暗示Nlrp6在调节线粒体功能和铁死亡中起着重要作用。
为了进一步验证Nlrp6在保护NSPCs免受皮质酮诱导的铁死亡中的作用,研究者们进行了siNlrp6转染和皮质酮暴露实验。他们发现,下调Nlrp6表达会抑制视黄酸诱导基因I(RIG-1)/线粒体抗病毒信号蛋白(MAVS)介导的自噬,从而驱动NSPCs的铁死亡。这一发现揭示了Nlrp6在调节自噬和铁死亡之间的新联系。
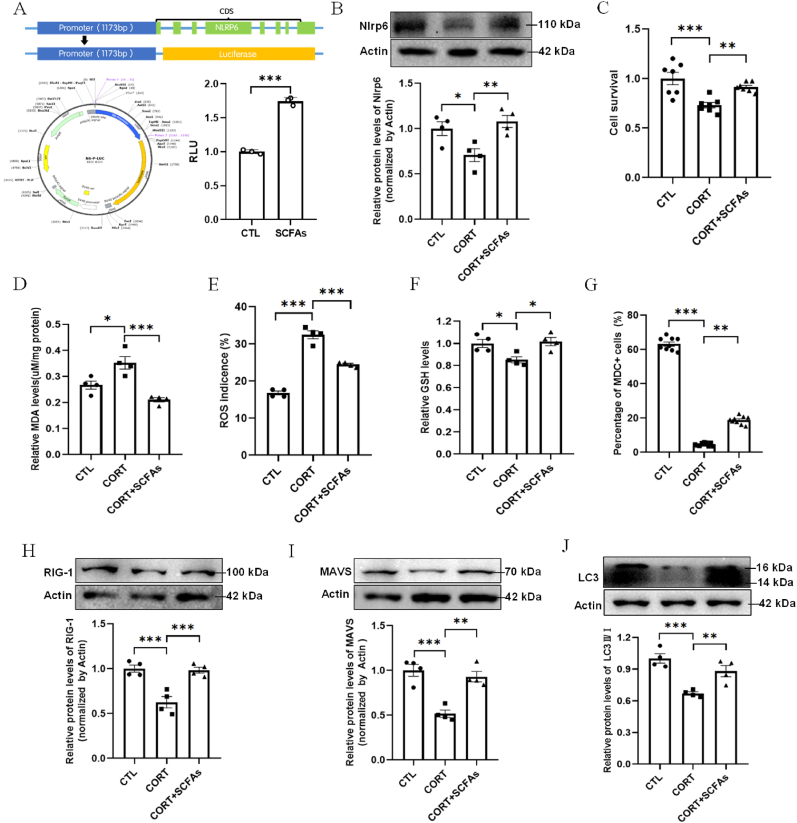
此外,研究者们还探索了短链脂肪酸(SCFAs)对Nlrp6表达和自噬的影响。他们发现,SCFAs能够上调Nlrp6表达,并促进RIG-1/MAVS介导的自噬,从而防止皮质酮诱导的NSPCs铁死亡。这一发现为通过调节肠道微生物代谢产物来改善神经退行性疾病提供了新的思路。
三、实验结果与讨论
- Nlrp6在NSPCs中的保护作用
研究结果显示,Nlrp6在NSPCs中高表达,并且对于维持海马神经生成至关重要。Nlrp6缺失导致小鼠出现认知缺陷和海马NSPCs数量显著减少。这一发现强调了Nlrp6在保护NSPCs免受应激刺激中的关键作用。
- Nlrp6缺失对线粒体能量生成和铁死亡的影响
RNA测序分析揭示了Nlrp6缺失会显著改变线粒体能量生成和铁死亡相关基因的表达谱。这一发现表明,Nlrp6可能通过调节线粒体功能来影响NSPCs的铁死亡过程。
- Nlrp6在调节自噬和铁死亡中的作用
下调Nlrp6表达会抑制RIG-1/MAVS介导的自噬,从而增加NSPCs对皮质酮诱导的铁死亡的敏感性。这一发现揭示了Nlrp6在调节自噬和铁死亡之间的新联系,并暗示了自噬在保护NSPCs免受铁死亡中的重要性。
- SCFAs对Nlrp6表达和自噬的调节
SCFAs能够上调Nlrp6表达,并促进RIG-1/MAVS介导的自噬,从而防止皮质酮诱导的NSPCs铁死亡。这一发现不仅为SCFAs的神经保护作用提供了新的证据,还为通过调节肠道微生物代谢产物来改善神经退行性疾病提供了新的策略。
四、研究意义与未来展望
本研究揭示了Nlrp6在保护NSPCs免受皮质酮诱导的铁死亡中的重要作用,并揭示了其通过调节RIG-1/MAVS介导的自噬来实现这一保护作用的分子机制。这一发现不仅为理解神经干细胞的应激反应提供了新的视角,还为神经退行性疾病的治疗提供了新的潜在靶点。
此外,本研究还发现SCFAs能够上调Nlrp6表达并促进自噬,从而防止NSPCs的铁死亡。这一发现为通过调节肠道微生物代谢产物来改善神经退行性疾病提供了新的思路。未来,研究者们可以进一步探索SCFAs在神经保护中的作用机制,并评估其作为神经退行性疾病治疗策略的潜力。
同时,本研究也强调了自噬在保护NSPCs免受铁死亡中的重要性。未来,研究者们可以进一步探索自噬调节剂在神经退行性疾病治疗中的应用,并评估其安全性和有效性。
总之,本研究为理解神经干细胞的应激反应和神经退行性疾病的发病机制提供了新的视角和潜在的治疗靶点。未来,随着研究的深入,我们有望开发出更有效的治疗方法来延缓或逆转神经退行性疾病的进程。



































