上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|铁基金属有机框架纳米酶在肿瘤铁死亡疗法中的创新应用
199 人阅读发布时间:2025-07-14 16:08
一、肿瘤铁死亡疗法的研究背景与挑战
肿瘤治疗一直是医学研究的重点领域之一,其中铁死亡(ferroptosis)作为一种新型的程序性细胞死亡方式,近年来受到了广泛关注。铁死亡涉及铁离子依赖的脂质过氧化过程,为肿瘤治疗提供了新的策略。然而,如何高效、特异地诱导肿瘤细胞发生铁死亡,同时减少对正常组织的损伤,是当前研究面临的重大挑战。近期,一篇题为《Iron (II)-based metal-organic framework nanozyme for boosting tumor ferroptosis through inhibiting DNA damage repair and system Xc》的研究论文,为肿瘤铁死亡疗法带来了新的突破。
二、铁基金属有机框架纳米酶的设计与创新
2.1 纳米酶的结构与特性
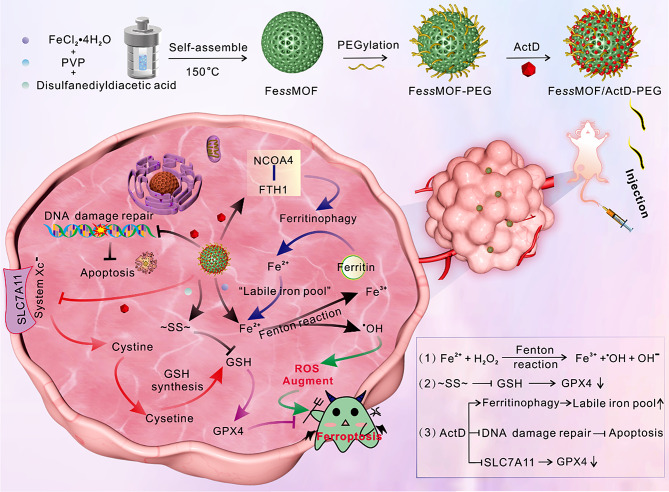
该研究设计了一种基于铁(II)的金属有机框架(Metal-Organic Framework, MOF)纳米酶,命名为FessMOF。FessMOF由二硫键和亚铁离子组装而成,具有独特的结构和功能特性。其过氧化物酶样活性使得FessMOF能够在特定条件下催化过氧化氢产生自由基,进而引发脂质过氧化,促进铁死亡的发生。此外,FessMOF还表现出pH/谷胱甘肽依赖的降解性,这使其在肿瘤微环境中具有响应性,能够更精准地作用于肿瘤细胞。
2.2 纳米酶的修饰与功能增强
为了进一步提高FessMOF的肿瘤治疗效率,研究者对其进行了PEGylation修饰,并负载了放线菌素D(Actinomycin D, ActD)。PEGylation不仅提高了FessMOF的生物相容性和稳定性,还减少了其在体内的非特异性清除,从而延长了血液循环时间,增加了肿瘤组织的富集。而ActD的负载则赋予了FessMOF额外的功能,即通过抑制DNA损伤修复系统和Xc-系统,进一步促进肿瘤细胞的铁死亡。
三、FessMOF纳米酶的作用机制与疗效评估
3.1 作用机制的多维度解析
FessMOF纳米酶在肿瘤铁死亡疗法中的作用机制复杂而精细。首先,其过氧化物酶样活性催化产生的自由基能够直接攻击肿瘤细胞的脂质膜,引发脂质过氧化,导致细胞膜破裂和细胞死亡。其次,FessMOF通过谷胱甘肽依赖的降解作用,消耗肿瘤细胞内的谷胱甘肽,从而降低其抗氧化能力,进一步加剧脂质过氧化过程。此外,ActD的抑制作用使得肿瘤细胞在DNA损伤后无法进行有效的修复,同时Xc-系统的抑制也减少了半胱氨酸的摄取,进而降低了谷胱甘肽的合成,进一步增强了铁死亡的效果。
3.2 体内外疗效的验证与评估
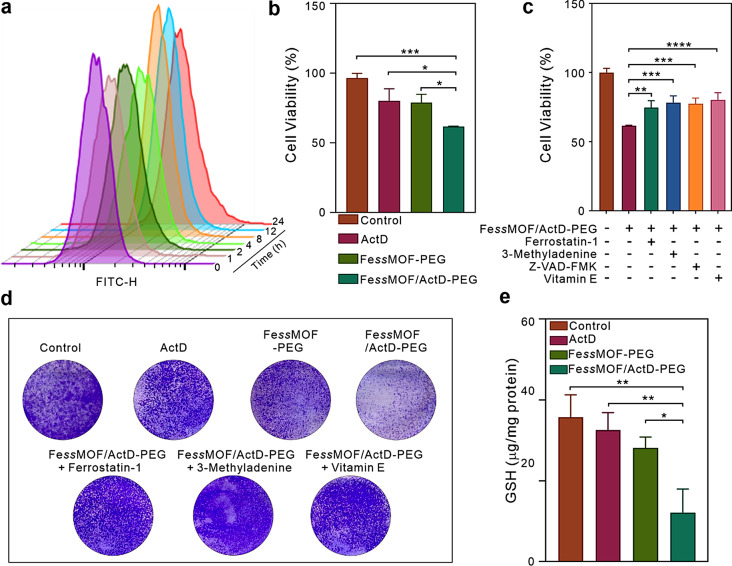
为了验证FessMOF纳米酶的肿瘤治疗效果,研究者进行了系统的体内外实验。在体外实验中,FessMOF/ActD-PEG纳米平台显著抑制了肿瘤细胞的增殖,并引发了明显的铁死亡特征。通过流式细胞术、荧光显微镜等手段观察到肿瘤细胞内脂质过氧化产物的增加和细胞膜的破裂。同时,western blot等分子生物学实验也证实了FessMOF对DNA损伤修复系统和Xc-系统的抑制作用。
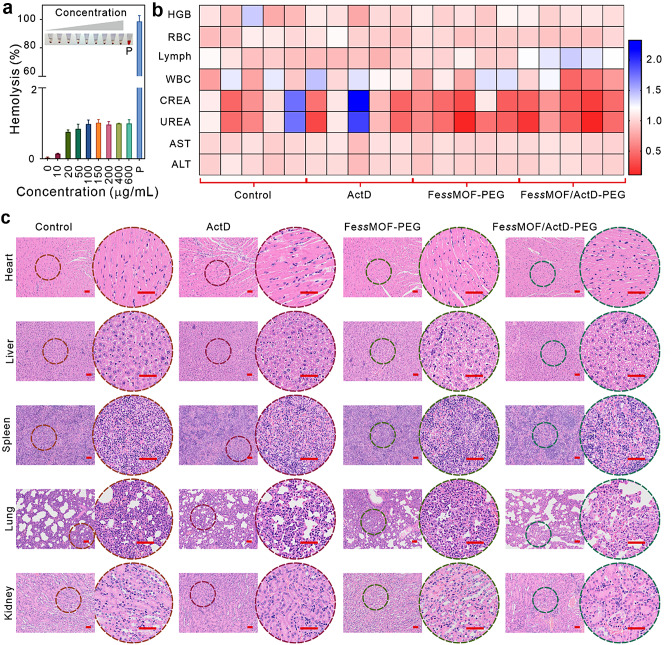
在体内实验中,研究者构建了肿瘤动物模型,并通过尾静脉注射给予了FessMOF/ActD-PEG纳米平台。结果显示,该纳米平台在肿瘤组织内具有良好的富集效果,且未对正常组织造成明显损伤。通过肿瘤体积测量、组织学分析等手段评估了治疗效果,发现FessMOF/ActD-PEG纳米平台能够显著抑制肿瘤的生长,肿瘤抑制率高达91.89%。此外,通过生物发光成像等技术还观察到了纳米平台在体内的分布和代谢情况,进一步证实了其安全性和有效性。
四、FessMOF纳米酶的临床应用前景与挑战
4.1 临床应用的前景展望
FessMOF纳米酶在肿瘤铁死亡疗法中的创新应用为肿瘤治疗提供了新的思路和策略。其独特的结构和功能特性使得其在体内外实验中均表现出显著的抗肿瘤效果,且具有良好的生物相容性和安全性。因此,FessMOF纳米酶有望成为未来肿瘤治疗的重要药物之一,特别是在对化疗、放疗等传统治疗方法不敏感的肿瘤患者中具有广阔的应用前景。
4.2 面临的挑战与应对策略
尽管FessMOF纳米酶在肿瘤铁死亡疗法中取得了显著的成果,但仍面临一些挑战。例如,如何进一步提高纳米酶的靶向性和稳定性,以减少其在体内的非特异性清除和降解;如何更精确地调控纳米酶的催化活性,以实现更精细的铁死亡诱导效果;以及如何评估纳米酶在体内的长期安全性和代谢情况等。针对这些挑战,研究者们正在不断探索和改进纳米酶的设计和制备工艺,以期在未来实现更精准、高效的肿瘤治疗。
五、结语
《Iron (II)-based metal-organic framework nanozyme for boosting tumor ferroptosis through inhibiting DNA damage repair and system Xc》这篇研究论文为肿瘤铁死亡疗法带来了新的突破和创新。FessMOF纳米酶的设计和创新不仅提高了肿瘤治疗的效率和特异性,还为未来纳米药物的发展提供了新的思路。尽管仍面临一些挑战,但随着研究的不断深入和技术的不断进步,相信FessMOF纳米酶将在未来的肿瘤治疗中发挥更加重要的作用。