上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|华中科技大学丁彬彬教授课题组揭示病毒促进脂滴与细胞器互作新机制
371 人阅读发布时间:2025-07-31 09:55
Coronaviral ORF6 protein mediates inter-organelle contacts and modulates host cell lipid flux for virus production
在生物化学与分子生物学的广阔领域中,病毒与宿主细胞的相互作用一直是研究的热点。近日,华中科技大学基础医学院生物化学与分子生物学系、华中科技大学细胞架构研究中心的丁彬彬教授课题组在国际知名期刊EMBO Journal上发表了一项重要研究成果,题为“Coronaviral ORF6 protein mediates inter-organelle contacts and modulates host cell lipid flux for virus production”。该研究揭示了冠状病毒辅助因子ORF6蛋白如何通过定位脂滴,并促进脂滴与内质网、线粒体的互作,从而调控脂质代谢,为病毒复制提供能量。以下是对该研究的详细解析。

一、研究背景与意义
脂滴,作为细胞内单层膜包裹的细胞器,主要功能是存储脂质,包括脂肪酸和固醇等。这些脂质在细胞代谢、信号传导以及维持细胞膜稳态中发挥着重要作用。当脂滴功能发生紊乱时,会导致一系列代谢性疾病,如肥胖、糖尿病和脂肪肝等。近年来,越来越多的研究表明,脂滴不仅参与细胞内的脂质代谢,还成为病毒复制和组装的重要平台。
冠状病毒,作为一类典型的细胞质复制病毒,必须在细胞质中重新建立自身的复制和代谢调控中心。已有的研究表明,冠状病毒如SARS-CoV-2感染会增强脂质合成关键酶的表达,导致脂滴数目的增加。而抑制脂肪酸合成酶则能显著降低病毒的复制。这些研究提示我们,脂质代谢重编程和脂滴的形成在冠状病毒复制中可能发挥重要作用。然而,关于冠状病毒如何调控脂质流向,以产生能量并用于病毒复制的分子机制,仍然是一个亟待解决的问题。
二、研究内容与发现
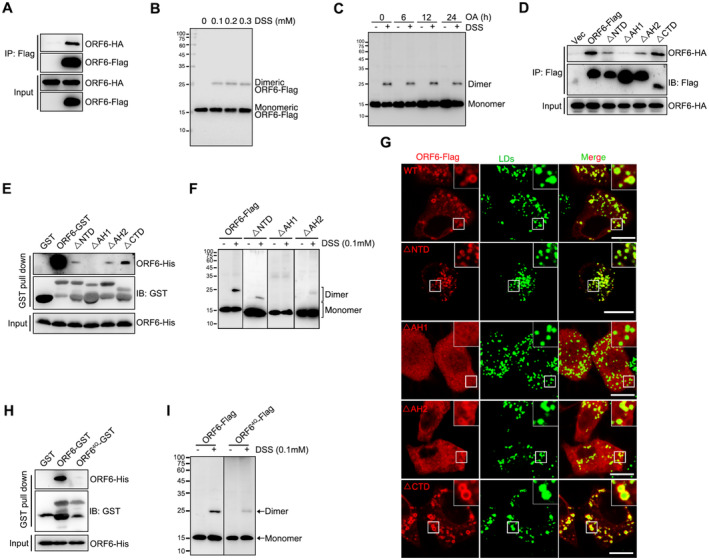
丁彬彬教授课题组的研究,正是针对这一科学问题展开的。他们首先观察到,冠状病毒辅助因子ORF6蛋白具有明显的脂滴定位。为了深入探究ORF6蛋白在脂滴定位中的机制,他们通过序列分析和构建各种功能域缺失突变以及关键氨基酸位点突变,发现ORF6蛋白的脂滴定位是由其双亲螺旋介导的。这一发现为后续研究提供了重要的理论基础。
接下来,课题组利用免疫金电镜技术,观察到ORF6蛋白在线粒体-脂滴和内质网-脂滴接触位点富集。这一结果暗示,ORF6蛋白可能在脂滴的合成和降解过程中发挥重要作用。为了验证这一假设,他们通过多种检测手段,对ORF6蛋白在脂质代谢调控中的功能进行了深入研究。
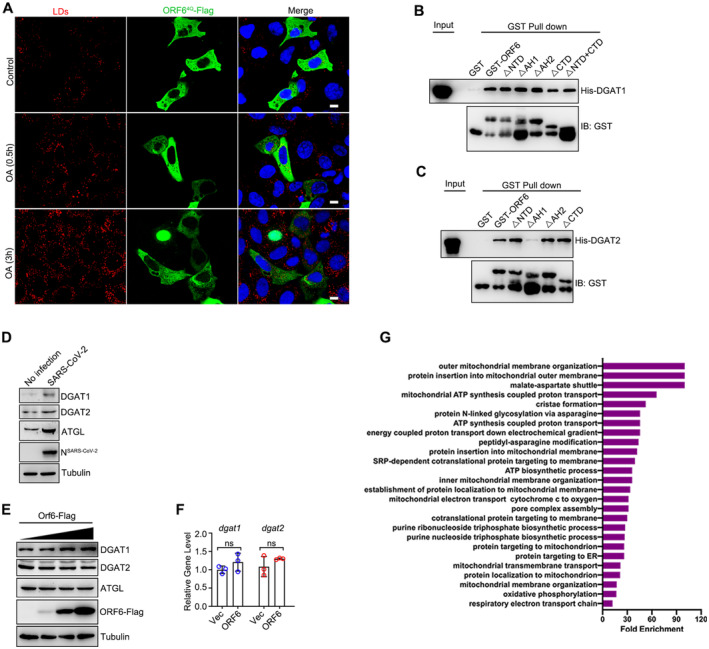
一方面,他们发现ORF6蛋白与脂质合成酶DGAT1/2相互作用,促进脂质合成。同时,ORF6蛋白还与内质网定位蛋白BAP31和USE1相互作用,介导内质网-脂滴互作。这一互作过程有助于新生脂滴的生成,为病毒复制提供必要的脂质来源。
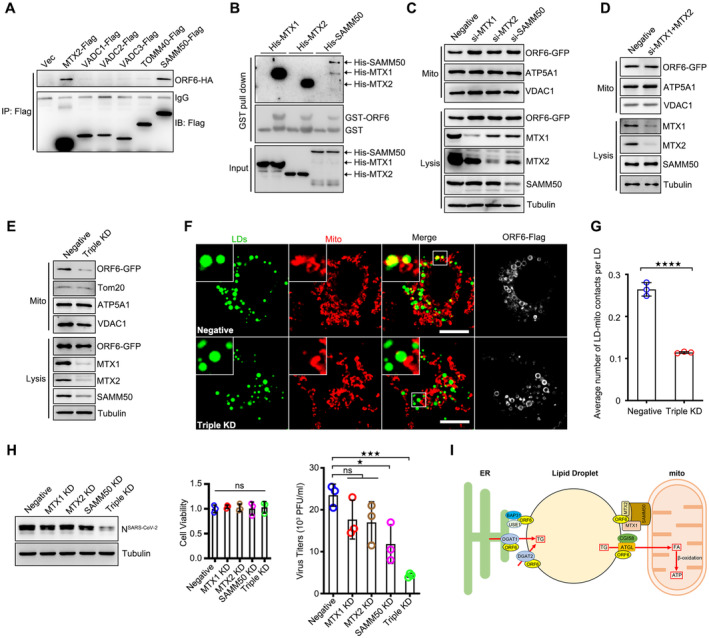
另一方面,他们发现ORF6蛋白与脂解酶ATGL相互作用,破坏ATGL与其负调控因子UBXD8和Plin2的相互作用,从而促进脂解。此外,ORF6蛋白还与线粒体外膜SAM复合物(MTX1/MTX2/SAMM50)相互作用,介导线粒体-脂滴互作。这一互作过程有助于脂滴脂解释放的脂肪酸进入线粒体进行β氧化,产生ATP为病毒复制提供能量。
三、研究机制与模式图
基于上述发现,丁彬彬教授课题组提出了一个全新的机制模型:冠状病毒辅助因子ORF6蛋白定位脂滴,通过介导脂滴与内质网、脂滴与线粒体的互作,促进脂滴的合成和降解。这一过程中,更多的脂肪酸被释放并进入线粒体进行β氧化,产生ATP为病毒复制提供能量。
为了更直观地展示这一机制,他们绘制了一幅模式图。在图中,我们可以看到ORF6蛋白如同一个“桥梁”,连接着脂滴、内质网和线粒体这三个重要的细胞器。通过这一“桥梁”,脂滴得以与内质网互作,促进新生脂滴的生成;同时,脂滴也与线粒体互作,释放脂肪酸进行β氧化。这一机制不仅揭示了冠状病毒如何调控脂质流向以满足病毒复制的能量需求,还为开发抗病毒药物和多肽提供了理论基础和潜在靶点。
四、研究意义与展望
丁彬彬教授课题组的研究不仅填补了冠状病毒调控脂质代谢机制领域的空白,还为抗病毒药物的开发提供了新的思路。通过抑制ORF6蛋白的功能或干扰其与脂滴、内质网和线粒体的互作,可能有望阻断病毒的复制过程,从而达到治疗病毒感染的目的。
此外,该研究还具有重要的理论意义。它揭示了脂滴在病毒感染过程中的重要作用,进一步拓展了我们对脂滴功能的认识。同时,该研究也为细胞器互作网络及其功能研究提供了新的视角和思路。
展望未来,丁彬彬教授课题组将继续深入探究冠状病毒与宿主细胞相互作用的机制,特别是病毒如何调控宿主细胞的代谢过程以满足其复制需求。他们相信,通过不懈的努力和深入的研究,他们将能够为抗击病毒感染贡献更多的智慧和力量。
五、结语
丁彬彬教授课题组在EMBO Journal上发表的这项研究成果,无疑为病毒学和生物化学领域带来了新的突破和启示。他们通过精细的实验设计和严谨的数据分析,揭示了冠状病毒辅助因子ORF6蛋白如何通过调控脂滴与内质网、线粒体的互作来重塑脂质代谢机制,为病毒复制提供能量。这一发现不仅为我们理解病毒感染的分子机制提供了新的视角和思路,也为抗病毒药物的开发提供了理论基础和潜在靶点。我们期待丁彬彬教授课题组在未来能够取得更多令人瞩目的研究成果,为人类的健康事业做出更大的贡献。
该研究得到了病毒学国家重点实验室开放课题、国家自然科学基金重大研究计划“细胞器互作网络及其功能研究”培育项目和国家自然科学基金联合基金重点支持项目的资助。这些资助为研究的顺利进行提供了有力的保障和支持。同时,我们也感谢所有参与该研究的人员和机构,他们的辛勤付出和无私奉献为这项研究成果的诞生奠定了坚实的基础。
| 名称 | 货号 | 规格 |
| ATGL Antibody | 2138S | 100ul |
| Calnexin Antibody | 2433S | 100ul |
| Tim23 (H-8) | sc-514463 | 200μg/ml |
| Tom20 (F-10) | sc-17764 | 200μg/ml |