上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|CD36介导的肿瘤细胞与巨噬细胞间代谢对话对肝转移的影响
233 人阅读发布时间:2025-04-16 10:55
引言
肝转移作为癌症相关死亡的主要原因之一,因其高度侵袭性和难治性而备受关注。尽管近年来癌症免疫疗法在治疗多种恶性肿瘤方面取得了显著成效,但仅有少数肝转移患者能够从中获益。肝转移灶中巨噬细胞的大量积累是导致免疫治疗反应降低和预后不良的关键因素之一。因此,深入了解肿瘤微环境(TME)中巨噬细胞的功能性重编程机制,对于改善肝转移的癌症免疫治疗效果具有重要意义。
近日,重庆医科大学阮雄中和陈压西团队在Nature Communications杂志上发表了一篇题为“CD36-mediated metabolic crosstalk between tumor cells and macrophages affects liver metastasis”的研究论文。该研究揭示了肿瘤细胞代谢与TME中巨噬细胞相互作用的机制,并提出了靶向CD36作为肝转移免疫疗法的治疗潜力。本文将对该研究进行详细的解析。

一、研究背景
- 癌症转移与肝转移
转移是癌症进展的标志性事件,也是导致癌症相关死亡的主要原因。肝脏作为人体内重要的代谢器官,是癌症转移最常见的部位之一。肝转移具有高度侵袭性,患者通常预后较差,治疗反应性降低。因此,肝转移的治疗一直是临床上的难题。
- 癌症免疫疗法
近年来,癌症免疫疗法在治疗多种恶性肿瘤方面取得了前所未有的成功。通过激活患者的免疫系统来对抗肿瘤,免疫疗法已经成为一种重要的治疗手段。然而,肝转移患者对免疫治疗的反应并不理想,仅有少数患者能够从中获益。
- 巨噬细胞在TME中的作用
巨噬细胞是浸润TME的最丰富的髓系细胞,具有原肿瘤M2样表型,能够促进肿瘤的起始、进展和转移。巨噬细胞在TME中发生代谢变化,以适应其局部环境,包括葡萄糖、脂质和谷氨酰胺代谢的改变。这些变化使得巨噬细胞形成了具有免疫抑制和抗炎活性的肿瘤促进表型。
- 脂质代谢与巨噬细胞功能
脂质稳态在控制巨噬细胞功能状态中的潜在作用越来越受到科学家们的关注。瘤内巨噬细胞脂质积累增强,有利于利用脂肪酸促进线粒体氧化磷酸化。然而,调控巨噬细胞脂质重编程的TME因子仍然难以捉摸。
二、研究概述
- 研究目的
本研究旨在揭示肿瘤细胞代谢与TME中巨噬细胞相互作用的机制,并探讨靶向CD36作为肝转移免疫疗法的治疗潜力。
- 研究方法
研究人员采用了lipid-pluse和细胞共培养技术,通过超速离心分离、脂质组学和细胞能量代谢分析等方法,深入研究了肿瘤细胞与巨噬细胞之间的代谢对话。同时,研究人员还利用巨噬细胞特异性CD36敲除小鼠进行了动物实验,以进一步验证CD36在TME中的功能。
- 研究结果
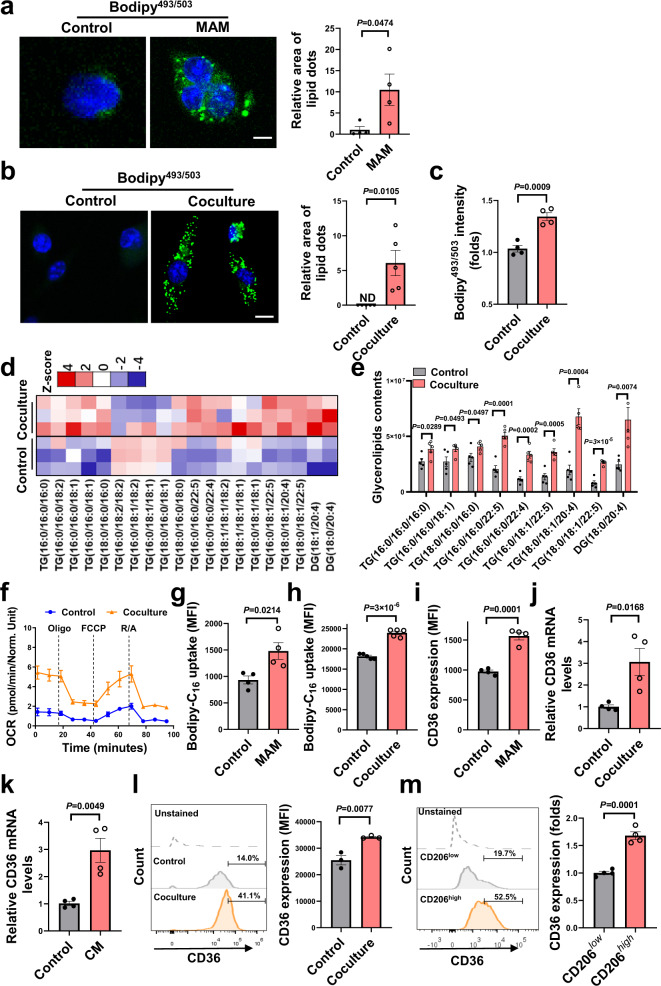
(1)肿瘤细胞向巨噬细胞传递脂肪酸
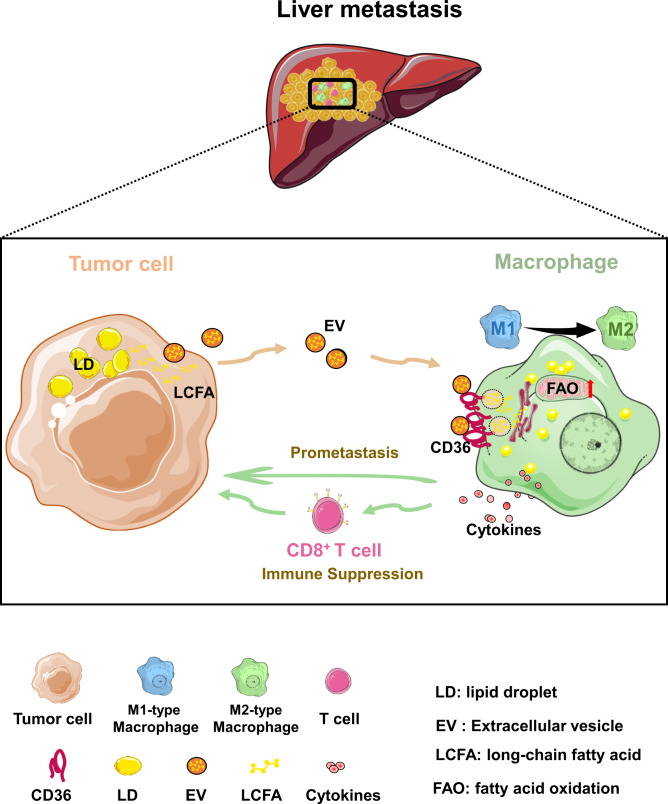
研究人员发现,标记到肿瘤细胞中的携带荧光的脂肪酸能够从肿瘤细胞转移到了巨噬细胞。通过超速离心分离,确认了脂肪酸的传递是以胞外囊泡为载体进行的细胞间传递,而不是载体蛋白。肿瘤细胞会特异性的将富含脂肪酸的囊泡转移至TAM细胞,这一过程依赖TAM上高表达的清道夫受体CD36。
(2)CD36介导巨噬细胞的代谢和功能重编程
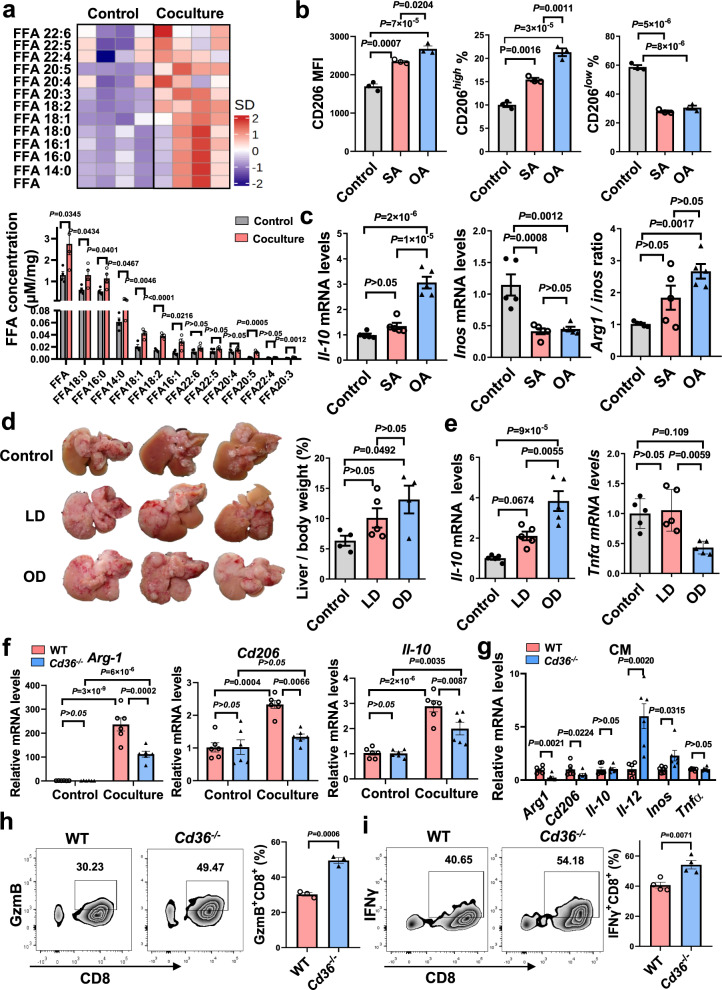
CD36能够介导肿瘤相关脂质的内化,随后驱动巨噬细胞的代谢和功能重编程。研究人员通过脂质组学和细胞能量代谢分析发现,TAM脂质组分的重塑,包括甘油三酯、甘油二酯等积累以及线粒体脂肪酸氧化的增强。肿瘤细胞释放的主要脂肪酸成分——油酸(18:1)可促进TAM的M2型极化,抑制CD8+T细胞的毒性作用。
(3)靶向CD36抑制肝转移
研究人员进一步发现,通过靶向CD36可以阻断肿瘤细胞向巨噬细胞传递脂肪酸的过程,从而抑制巨噬细胞中的脂质沉积,改善M2型极化和免疫抑制性。动物实验结果表明,巨噬细胞特异性CD36敲除小鼠的肝转移受到显著抑制,同时B细胞和T细胞(包括细胞毒性CD8+T细胞)的频率增加。
三、详细解析
- 肿瘤微环境与巨噬细胞代谢
由于肿瘤细胞的高代谢活性,TME的特征通常为缺氧、酸性和营养消耗。此外,与肿瘤相关的代谢物如一氧化氮、活性氧和腺苷等也影响着TME的组成和肿瘤浸润免疫细胞的功能。越来越多的证据表明,肿瘤中脂质代谢的激活提供了丰富的脂质代谢产物,导致了肿瘤的发展和局部TME的多样性。
巨噬细胞在TME中发生代谢变化以适应其局部环境。这些变化包括葡萄糖、脂质和谷氨酰胺代谢的改变。瘤内巨噬细胞脂质积累增强,有利于利用脂肪酸促进线粒体氧化磷酸化。然而,调控巨噬细胞脂质重编程的TME因子仍然难以捉摸。本研究通过揭示肿瘤细胞向巨噬细胞传递脂肪酸的过程,为理解巨噬细胞代谢重编程提供了新的视角。
- CD36在巨噬细胞代谢重编程中的作用
CD36是一种清道夫受体,能够识别并介导细胞对外源性脂质的摄取。本研究发现,CD36在TAM中高表达,并介导了肿瘤细胞向巨噬细胞传递脂肪酸的过程。通过靶向CD36,可以阻断这一过程,从而抑制巨噬细胞中的脂质沉积和M2型极化。
进一步的研究表明,CD36缺失的巨噬细胞在摄取肿瘤细胞分泌的胞外囊泡和脂肪酸方面受到抑制。同时,这些巨噬细胞的脂质组分和代谢特征也发生了改变,如脂肪酸、甘油三酯、甘油二酯的积聚减少,外源性脂肪酸摄取能力降低,线粒体脂肪酸氧化减弱。这些变化表明,CD36是调控巨噬细胞脂质代谢重塑与功能极化的关键因子。
- CD36作为肝转移免疫疗法的治疗潜力
本研究通过动物实验验证了靶向CD36对肝转移的抑制作用。巨噬细胞特异性CD36敲除小鼠在肝转移方面表现出显著的抑制作用,同时B细胞和T细胞(包括细胞毒性CD8+T细胞)的频率增加。这些结果表明,在MAMs上缺失CD36可以增强CD8+T细胞免疫力,达到抗肿瘤作用。
此外,研究人员还对人肿瘤样本进行了分析,发现CD36高表达的肿瘤患者中M2型TAM浸润显著增加,而T细胞的占比降低。这些结果进一步支持了靶向CD36作为肝转移免疫疗法的治疗潜力。
四、研究意义与展望
- 研究意义
本研究揭示了肿瘤细胞代谢与TME中巨噬细胞相互作用的机制,提出了靶向CD36作为肝转移免疫疗法的治疗潜力。这不仅为理解肝转移的发病机制提供了新的视角,也为开发新的肝转移治疗策略提供了理论基础和实验依据。
- 未来展望
未来的研究可以进一步探讨CD36在TME中的其他功能及其与其他代谢通路的相互作用。同时,可以开发针对CD36的特异性抑制剂或抗体药物,并进行临床试验以验证其治疗效果。此外,还可以结合其他免疫治疗手段如CAR-T细胞疗法等,探索联合治疗的可行性及其在提高肝转移患者生存率方面的作用。
结语
本研究通过揭示肿瘤细胞与巨噬细胞之间的代谢对话机制及其与肝转移的关系,为理解肝转移的发病机制提供了新的视角。靶向CD36作为肝转移免疫疗法的治疗潜力为开发新的肝转移治疗策略提供了理论基础和实验依据。未来的研究将进一步深入探索CD36在TME中的功能及其与其他代谢通路的相互作用,为肝转移的治疗开辟新的道路。
| 名称 | 货号 | 规格 |
| Rabbit anti-MRC1 Polyclonal Antibody | abs125294-50ul | 50ul |
| CD31 (PECAM-1) (D8V9E) XP ® Rabbit mAb | 77699T | 20ul |
| Purified NA/LE Hamster Anti-Mouse CD28(37.51) | 553294 | 500ug |
| Purified NA/LE Hamster Anti-Mouse CD3e(145-2C11) | 553057 | 500ug |



































