上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|CAV1-CAVIN1-LC3B介导的自噬调节高血糖刺激的LDL跨内皮穿胞转运
93 人阅读发布时间:2025-04-24 15:53
引言
糖尿病作为心脑血管疾病的高危因素之一,一直以来都备受医学界的关注。动脉粥样硬化作为糖尿病的主要并发症之一,其发病机制复杂,涉及多种因素。近年来,越来越多的研究表明,自噬(autophagy)在动脉粥样硬化的发生发展中起着重要作用。本文旨在解析一篇题为《CAV1-CAVIN1-LC3B-mediated autophagy regulates high glucose-stimulated LDL transcytosis》的研究文章,探讨高血糖如何通过抑制CAV1-CAVIN1-LC3B介导的自噬通路,促进低密度脂蛋白(LDL)跨内皮穿胞转运,进而加速动脉粥样硬化的发生发展。

文献概述
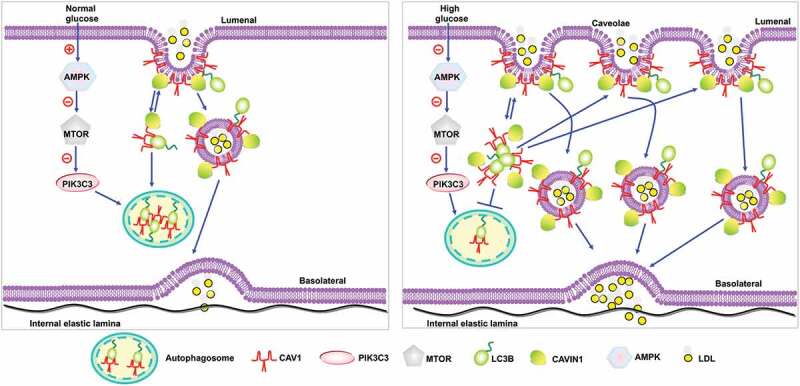
该文章由金肆教授团队与杨晓燕副教授团队合作完成,并于2019年8月26日在线发表于国际著名期刊《Autophagy》。该研究首次阐释了高血糖抑制CAV1-CAVIN1-LC3B介导的自噬通路,促进LDL跨内皮穿胞转运的分子机制,为糖尿病动脉粥样硬化的防治提供了新的治疗靶点。文章的主要结论包括:高血糖通过抑制AMPK-MTOR-PIK3C3信号途径,减少CAV1的自噬性降解,从而增加小凹(caveolae)的数量,促进LDL跨内皮转运,进而加速动脉粥样硬化的发生发展。
研究背景
动脉粥样硬化是一种慢性血管炎症性疾病,其发病机制涉及多种细胞和分子的相互作用。LDL在动脉粥样硬化中扮演着重要角色。正常情况下,LDL通过受体介导的内吞作用进入细胞,并在溶酶体内降解。然而,在高血糖等危险因素的作用下,LDL的代谢途径发生改变,导致其异常沉积在血管内膜下,进而触发动脉粥样硬化的发生。
自噬是一种细胞内的降解过程,通过双层膜包裹细胞内的蛋白质或细胞器等成分形成自噬小体,然后自噬小体和溶酶体融合降解自噬小体。自噬在维持细胞内稳态、清除受损细胞器和病原体等方面发挥着重要作用。近年来,越来越多的研究表明,自噬在动脉粥样硬化的发生发展中也起着重要作用。然而,高血糖如何影响自噬过程,进而促进LDL跨内皮穿胞转运的具体机制尚不完全清楚。
研究目的
本研究旨在探讨高血糖如何通过抑制CAV1-CAVIN1-LC3B介导的自噬通路,促进LDL跨内皮穿胞转运,进而加速动脉粥样硬化的发生发展。同时,通过临床样本验证高糖抑制自噬促进脂蛋白沉积的现象,为糖尿病动脉粥样硬化的防治提供新的治疗靶点。
研究方法
- 体外实验:利用人脐静脉内皮细胞(HUVECs)建立LDL穿胞模型,观察高糖对自噬过程的影响及LDL穿胞的变化。
- 分子机制探讨:通过抑制AMPK-MTOR-PIK3C3信号途径,观察CAV1自噬性降解的变化,以及小凹数量和LDL穿胞的关系。
- 临床样本验证:收集妊娠糖尿病(GDM)孕妇和非GDM孕妇的脐带血管样本,比较内膜下脂质沉积和小凹组成蛋白(CAV1、CAVIN1)及自噬标志性蛋白LC3B的表达。
研究结果
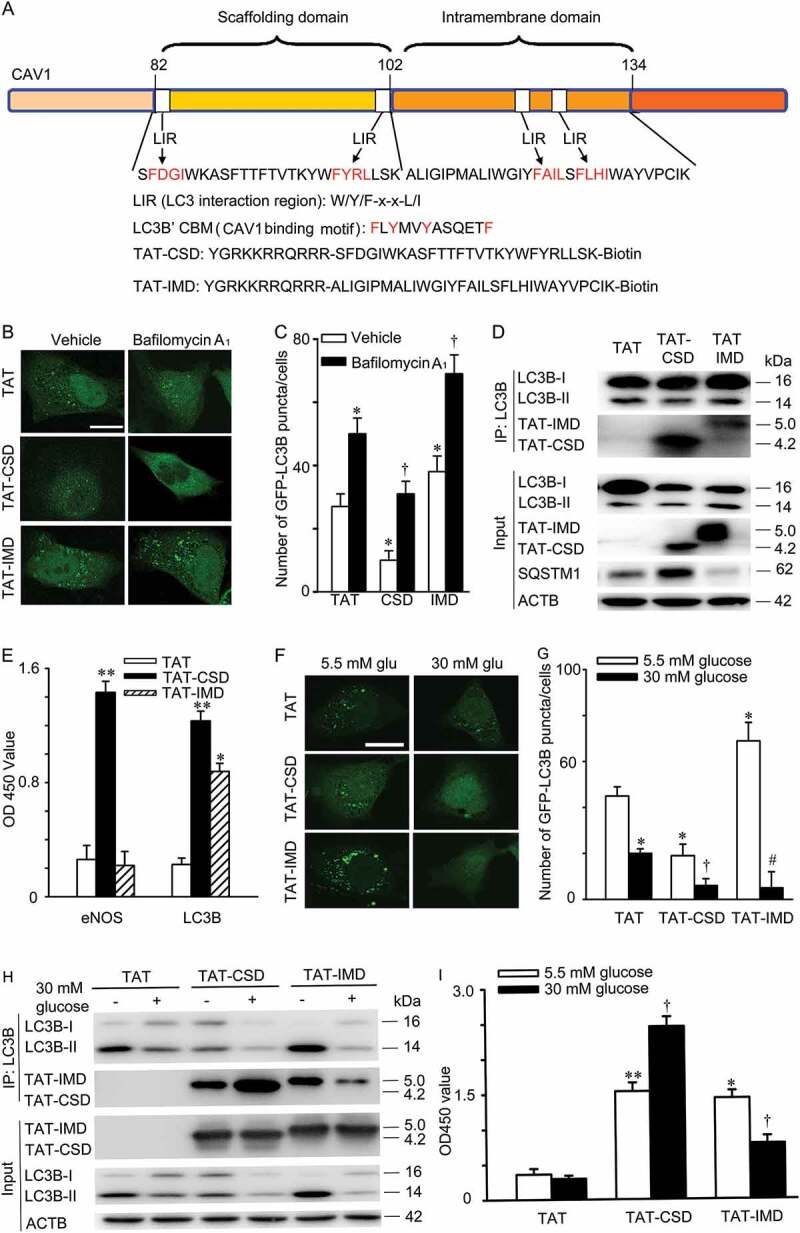
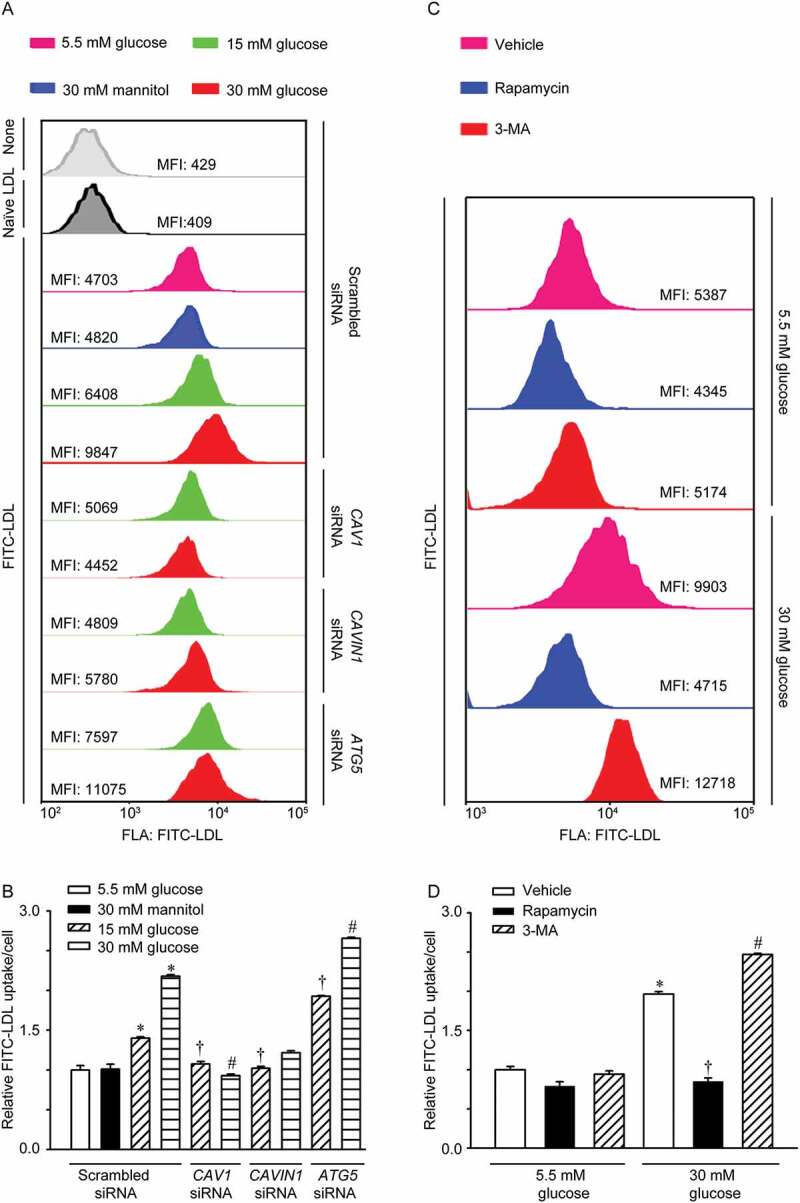
- 高糖促进LDL跨内皮穿胞转运:高糖处理HUVECs后,LDL跨内皮穿胞转运显著增加。这一作用依赖于高糖增加了CAV1-CAVIN1-LC3B的相互作用,促进了小凹介导的LDL穿胞。
- 高糖抑制自噬:高糖通过抑制AMPK-MTOR-PIK3C3信号途径,减少CAV1的自噬性降解,导致CAV1在胞浆中积累,并用于形成更多的小凹。
- 小凹数量增加促进LDL穿胞:高糖增加小凹数量,进而促进LDL跨内皮转运。这一作用依赖于小凹组成蛋白CAV1和CAVIN1的表达增加。
- 临床样本验证:相比非GDM孕妇,GDM孕妇脐血管内膜下的脂质沉积明显增加,小凹组成蛋白CAV1和CAVIN1表达显著增加,同时伴随着自噬标志性蛋白LC3B表达减少,进一步在体证实了高糖抑制自噬促进脂蛋白沉积的现象。
研究结果解析
- 高糖对自噬的影响:本研究发现,高糖通过抑制AMPK-MTOR-PIK3C3信号途径,减少CAV1的自噬性降解。AMPK是一种能量感受器,能够感知细胞内能量状态并调节代谢过程。MTOR是自噬过程中的关键调节因子,能够抑制自噬的启动。PIK3C3是自噬小体形成过程中的关键酶。高糖抑制AMPK的激活,导致MTOR活性增加,进而抑制PIK3C3的活性,减少CAV1的自噬性降解。
- CAV1与自噬的关系:CAV1是自噬过程中的重要靶点之一。在自噬过程中,CAV1可以被LC3B募集进入自噬小体,并发生自噬性降解。本研究发现,高糖抑制CAV1的自噬性降解,导致CAV1在胞浆中积累,并用于形成更多的小凹。小凹是细胞膜上的微小凹陷,能够介导LDL的跨内皮穿胞转运。因此,高糖通过增加小凹数量,促进LDL跨内皮转运。
- LDL跨内皮穿胞转运与动脉粥样硬化的关系:LDL是动脉粥样硬化的主要危险因素之一。LDL通过受体介导的内吞作用进入细胞后,在溶酶体内降解。然而,在高血糖等危险因素的作用下,LDL的代谢途径发生改变,导致其异常沉积在血管内膜下,进而触发动脉粥样硬化的发生。本研究发现,高糖促进LDL跨内皮穿胞转运,导致其在血管内膜下异常沉积,进而加速动脉粥样硬化的发生发展。
- 临床样本验证:本研究通过收集GDM孕妇和非GDM孕妇的脐带血管样本,进一步验证了高糖抑制自噬促进脂蛋白沉积的现象。相比非GDM孕妇,GDM孕妇脐血管内膜下的脂质沉积明显增加,小凹组成蛋白CAV1和CAVIN1表达显著增加,同时伴随着自噬标志性蛋白LC3B表达减少。这一结果进一步证实了高糖抑制自噬促进脂蛋白沉积的分子机制。
研究意义
本研究首次阐释了高血糖抑制CAV1-CAVIN1-LC3B介导的自噬通路,促进LDL跨内皮穿胞转运的分子机制,为糖尿病动脉粥样硬化的防治提供了新的治疗靶点。具体而言,本研究的意义包括:
- 揭示新机制:本研究揭示了高血糖抑制自噬促进LDL跨内皮穿胞转运的新机制,为动脉粥样硬化的发生发展提供了新的解释。
- 提供新靶点:本研究发现高糖通过抑制AMPK-MTOR-PIK3C3信号途径减少CAV1的自噬性降解,从而增加小凹数量促进LDL穿胞。因此,AMPK、MTOR和PIK3C3等信号分子可能成为治疗糖尿病动脉粥样硬化的新靶点。
- 指导临床干预:本研究通过临床样本验证,发现GDM孕妇脐血管内膜下的脂质沉积明显增加,小凹组成蛋白表达增加,自噬标志性蛋白表达减少。这一结果提示,对于糖尿病患者,应尽早控制血糖水平,减少LDL的跨内皮穿胞转运,从而预防动脉粥样硬化的发生。
研究展望
尽管本研究已经揭示了高血糖抑制CAV1-CAVIN1-LC3B介导的自噬通路促进LDL跨内皮穿胞转运的分子机制,但仍有许多问题有待进一步探讨:
- 信号通路深入研究:本研究发现高糖通过抑制AMPK-MTOR-PIK3C3信号途径减少CAV1的自噬性降解,但这一信号通路的具体调节机制尚不清楚。未来研究可以进一步探讨AMPK、MTOR和PIK3C3等信号分子的相互作用及调节机制。
- 小凹介导的LDL穿胞机制:本研究发现高糖增加小凹数量促进LDL跨内皮转运,但小凹介导的LDL穿胞的具体机制尚不完全清楚。未来研究可以进一步探讨小凹的结构和功能,以及其与LDL穿胞的关系。
- 临床干预研究:本研究通过临床样本验证高糖抑制自噬促进脂蛋白沉积的现象,但尚未开展临床干预研究。未来研究可以探索针对AMPK、MTOR和PIK3C3等信号分子的药物干预,评估其在糖尿病动脉粥样硬化防治中的疗效和安全性。
结论
本研究首次揭示了高血糖抑制CAV1-CAVIN1-LC3B介导的自噬通路促进LDL跨内皮穿胞转运的分子机制。高糖通过抑制AMPK-MTOR-PIK3C3信号途径减少CAV1的自噬性降解,导致CAV1在胞浆中积累并用于形成更多的小凹,进而促进LDL跨内皮转运和动脉粥样硬化的发生发展。本研究为糖尿病动脉粥样硬化的防治提供了新的治疗靶点,具有重要的理论意义和临床价值。未来研究将进一步探讨相关信号通路的调节机制、小凹介导的LDL穿胞机制以及临床干预效果,为糖尿病动脉粥样硬化的防治提供更全面的科学依据。
| 名称 | 货号 | 规格 |
| eNOS (D9A5L) Rabbit mAb | 32027S | 100ul |
| Caveolin-1 (D46G3) XP ® Rabbit mAb | 3267S | 100ul |
| SQSTM1/p62 (D1Q5S) Rabbit mAb | 39749S | 100ul |
| eNOS (D9A5L) Rabbit mAb | 32027T | 20μl |