上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|脉动流增强METTL14诱导的m⁶A修饰并减轻脓毒症心肌病
225 人阅读发布时间:2025-04-28 16:19
摘要
脓毒症心肌病(Septic cardiomyopathy)是一种由脓毒症介导的心血管并发症,表现为严重的微循环灌注不足。越来越多的证据表明,在微循环障碍的情况下,脉动流具有保护作用,但其潜在机制仍不明确。本研究旨在探讨N⁶-甲基腺苷(m⁶A)修饰在体外膜肺氧合(ECMO)产生的脉动流减轻脓毒症心肌病中的作用机制。通过建立脓毒症心肌病大鼠模型,并在ECMO支持下分别给予脉动流和非脉动流,我们发现脉动流显著提高了微循环灌注指数(PPI),改善了心功能,保护了内皮细胞,并延长了脓毒症心肌病大鼠的生存时间。脉动流通过METTL14介导的m⁶A修饰作用于紧密连接蛋白1(ZO-1)mRNA,依赖YTHDF2稳定ZO-1 mRNA。此外,脉动流抑制了PI3K-Akt信号通路,其下游分子Foxo1作为METTL14的负性转录因子,与METTL14启动子结合,抑制METTL14诱导的m⁶A修饰。本研究表明,ECMO产生的脉动流通过增加ZO-1的METTL14诱导的m⁶A修饰,减轻了脓毒症心肌病的进展,提示脉动性可能成为脓毒症心肌病的新治疗策略,通过减轻微循环障碍发挥作用。
引言
脓毒症心肌病是脓毒症的一种严重并发症,其特征是心肌功能障碍和微循环灌注不足,导致心脏泵血功能下降,全身氧供不足。脓毒症心肌病的高发病率和死亡率使其成为临床治疗的难点和重点。近年来,体外膜肺氧合(ECMO)作为一种有效的循环支持手段,在脓毒症心肌病的治疗中发挥了重要作用。然而,不同ECMO模式对脓毒症心肌病的影响及其机制尚不完全清楚。
脉动流是ECMO的一种重要模式,其模拟人体自然循环的脉动特性,被认为具有更好的生理相容性和血流动力学效果。近年来,越来越多的研究表明,脉动流在改善微循环、保护内皮细胞、减轻炎症反应等方面具有显著优势。然而,脉动流对脓毒症心肌病的具体作用及其机制仍缺乏深入研究。
N⁶-甲基腺苷(m⁶A)是真核生物mRNA中最常见的修饰类型之一,参与调控基因表达、RNA代谢和疾病发生等多个过程。近年来,m⁶A修饰在心血管疾病中的作用逐渐受到关注。然而,m⁶A修饰是否参与脓毒症心肌病的发生和发展,以及脉动流是否通过调控m⁶A修饰影响脓毒症心肌病,尚不清楚。
本研究旨在探讨脉动流对脓毒症心肌病的影响及其机制,特别是关注m⁶A修饰在其中的作用。通过建立脓毒症心肌病大鼠模型,并在ECMO支持下分别给予脉动流和非脉动流,我们观察了心功能、微循环灌注、内皮细胞损伤等指标的变化,并深入研究了m⁶A修饰及其相关分子的调控机制。本研究将为脓毒症心肌病的治疗提供新的思路和方法。
材料与方法
- 实验动物与分组
选用健康雄性Sprague Dawley大鼠,体重250-300g,随机分为三组:对照组(未接受脓毒症诱导和ECMO支持)、非脉动流组(接受脓毒症诱导并在ECMO支持下给予非脉动流)和脉动流组(接受脓毒症诱导并在ECMO支持下给予脉动流)。每组10只大鼠。
- 脓毒症心肌病模型建立
采用盲肠结扎穿孔法(CLP)诱导大鼠脓毒症。具体步骤如下:大鼠麻醉后,于腹部正中线做切口,找到盲肠并结扎其远端1/3处,然后用18号针头穿刺盲肠两次,间距约1cm,挤出少量肠内容物后还纳腹腔,逐层缝合切口。术后给予大鼠抗生素预防感染。
- ECMO支持与脉动流/非脉动流给予
大鼠脓毒症诱导后24小时,建立ECMO支持。采用股动脉-股静脉插管法建立体外循环通路,使用小型离心泵和氧合器维持血液循环。脉动流组设置ECMO泵的频率和波形以模拟人体自然循环的脉动特性;非脉动流组则设置ECMO泵为持续恒流模式。
- 心功能与微循环灌注监测
使用超声心动图监测大鼠心功能指标,包括左心室射血分数(LVEF)、左心室舒张末期容积(LVEDV)和左心室收缩末期容积(LVESV)。同时,使用激光多普勒血流仪监测大鼠微循环灌注指数(PPI),评估微循环状态。
- 样本收集与检测
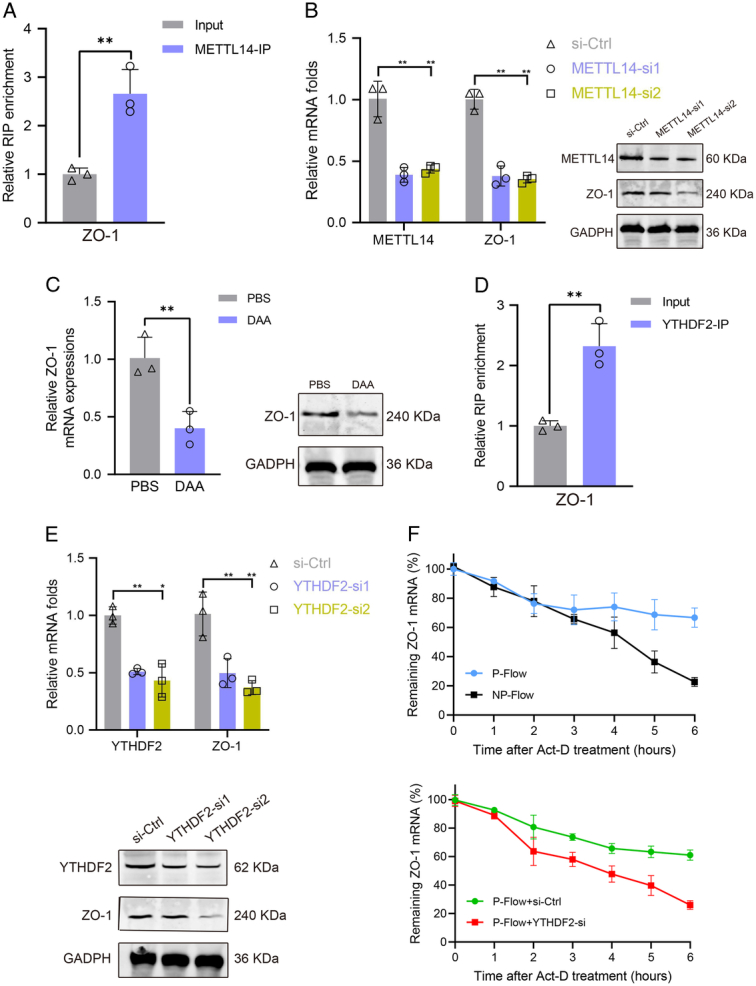
大鼠在ECMO支持下维持48小时后,收集心脏组织样本用于后续检测。使用dot blot assay检测m⁶A水平;使用qRT-PCR、Western blot、免疫荧光和免疫组化检测相关基因和蛋白的表达水平;使用RNA免疫沉淀实验(RIP)验证分子间的相互作用。
结果
- 脉动流改善心功能与微循环灌注
与对照组相比,非脉动流组和脉动流组大鼠的心功能均显著下降(P<0.05),但脉动流组大鼠的心功能指标(LVEF、LVEDV、LVESV)均优于非脉动流组(P<0.05)。同时,脉动流组大鼠的微循环灌注指数(PPI)显著高于非脉动流组(P<0.05),表明脉动流能够改善脓毒症心肌病大鼠的心功能和微循环灌注。
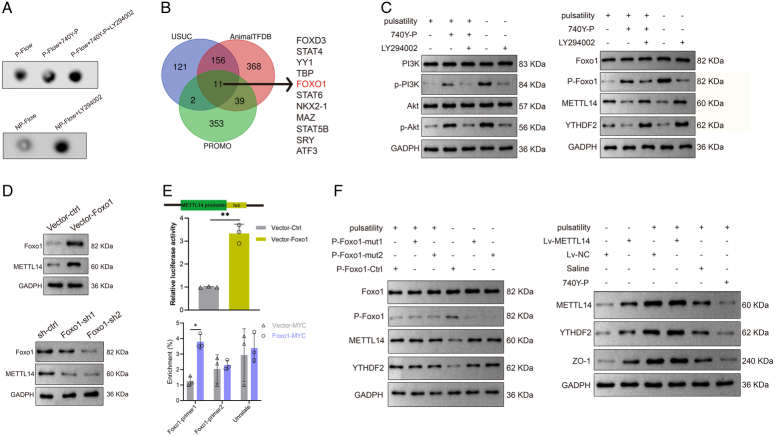
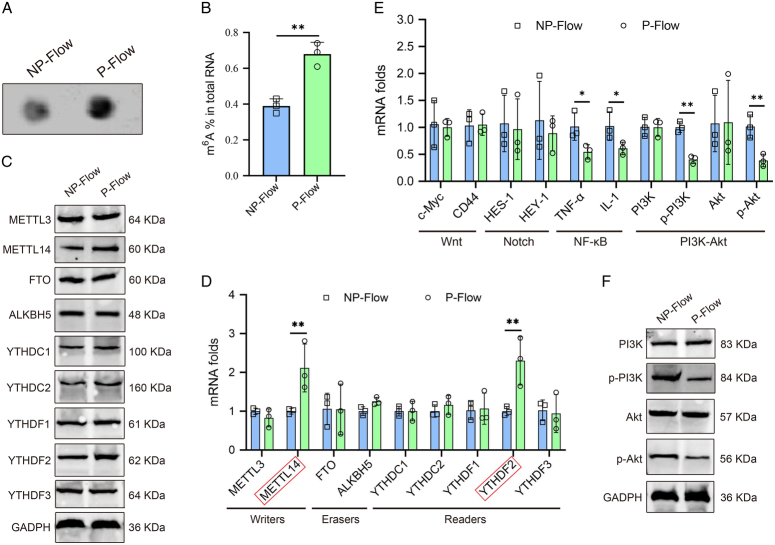
- 脉动流促进METTL14介导的m⁶A修饰
使用dot blot assay检测大鼠心脏组织中的m⁶A水平,发现脉动流组大鼠心脏组织中的m⁶A水平显著高于非脉动流组(P<0.05)。进一步使用qRT-PCR和Western blot检测METTL14的表达水平,发现脉动流组大鼠心脏组织中的METTL14 mRNA和蛋白水平均显著高于非脉动流组(P<0.05)。这些结果表明,脉动流能够促进METTL14介导的m⁶A修饰。
- 脉动流稳定ZO-1 mRNA并促进其表达
使用qRT-PCR和Western blot检测ZO-1 mRNA和蛋白的表达水平,发现脉动流组大鼠心脏组织中的ZO-1 mRNA和蛋白水平均显著高于非脉动流组(P<0.05)。进一步使用免疫荧光和免疫组化观察ZO-1的定位和分布,发现脉动流组大鼠心脏组织中的ZO-1主要定位于心肌细胞间隙,且分布均匀,而非脉动流组大鼠心脏组织中的ZO-1则呈现明显的断裂和缺失。这些结果表明,脉动流能够稳定ZO-1 mRNA并促进其表达。
- 脉动流抑制PI3K-Akt信号通路并下调Foxo1表达
使用Western blot检测PI3K-Akt信号通路相关分子的表达水平,发现脉动流组大鼠心脏组织中的PI3K和Akt磷酸化水平均显著低于非脉动流组(P<0.05)。进一步使用qRT-PCR和Western blot检测Foxo1的表达水平,发现脉动流组大鼠心脏组织中的Foxo1 mRNA和蛋白水平均显著低于非脉动流组(P<0.05)。这些结果表明,脉动流能够抑制PI3K-Akt信号通路并下调Foxo1表达。
- Foxo1作为METTL14的负性转录因子调控m⁶A修饰
使用RIP实验验证Foxo1与METTL14之间的相互作用关系。结果显示,Foxo1能够与METTL14启动子区域结合,并抑制METTL14的表达。进一步分析发现,Foxo1作为METTL14的负性转录因子,通过抑制METTL14的表达进而抑制m⁶A修饰。这些结果表明,Foxo1在脉动流调控METTL14介导的m⁶A修饰中发挥着重要作用。
结论
本研究通过建立脓毒症心肌病大鼠模型并在ECMO支持下给予脉动流和非脉动流,探讨了脉动流对脓毒症心肌病的影响及其机制。结果表明,脉动流能够显著改善脓毒症心肌病大鼠的心功能和微循环灌注;促进METTL14介导的m⁶A修饰;稳定ZO-1 mRNA并促进其表达;抑制PI3K-Akt信号通路并下调Foxo1表达。这些发现为脓毒症心肌病的治疗提供了新的思路和方法。
本研究还发现,Foxo1作为METTL14的负性转录因子,在脉动流调控METTL14介导的m⁶A修饰中发挥着重要作用。这一发现不仅揭示了Foxo1在心血管疾病中的新功能,也为深入理解m⁶A修饰在心血管疾病中的作用提供了新的视角。
然而,本研究仍存在一些局限性。例如,本研究仅在大鼠模型中进行了实验验证,尚需进一步在人体中进行临床研究以验证其安全性和有效性。此外,本研究仅探讨了脉动流对脓毒症心肌病的影响及其机制之一——m⁶A修饰的调控作用,尚需进一步深入研究其他可能的机制。
综上所述,本研究表明ECMO产生的脉动流通过增加METTL14诱导的m⁶A修饰并减轻脓毒症心肌病的进展,为脓毒症心肌病的治疗提供了新的策略和方法。未来的研究将进一步深入探索脉动流在心血管疾病中的作用机制及其临床应用价值。
| 名称 | 货号 | 规格 |
| Hoechst 33342 | abs813337-10mg | 10mg |
| DAB显色试剂盒(棕黄色,IHC) | abs9210-1kit | 1kit |
| 苏木素染液 | abs9214-100ml | 100ml |
| 中性树胶(镜检用永久封片剂) | abs9177-100ml | 100ml |