上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|PSD-95突触后致密区的动态调控与阿尔茨海默病的关系
565 人阅读发布时间:2025-05-07 11:05
PSD-95
引言
突触后致密区(Postsynaptic Density,PSD)是神经元突触结构中的一个关键组成部分,其复杂的蛋白质组成和高度动态的特性对于神经传递和突触可塑性至关重要。PSD包含了数百种连接到跨膜受体的信号和支架蛋白,这些蛋白在突触功能、神经元连接以及神经网络活动中起着核心作用。PSD-95作为PSD中的主要支架蛋白之一,其功能和相互作用的研究一直是神经科学领域的热点。本文将基于《Nature Communications》上发表的题为“Multivalent Tau/PSD-95 interactions arrest in vitro condensates and clusters mimicking the postsynaptic density”的研究论文,深入解析PSD-95在神经突触后区的动态调控及其与阿尔茨海默病(Alzheimer's Disease,AD)之间的关系。

PSD的结构与功能
PSD位于神经元突触后膜的胞质面,是一个电子密度高的区域,厚度约为30-50纳米。PSD内含有数百种蛋白质,包括离子通道、受体、信号分子和支架蛋白,这些成分共同维持着突触的结构和功能。PSD-95是一种膜相关鸟苷酸激酶(Membrane-Associated Guanylate Kinase,MAGUK)蛋白,是PSD中最丰富的蛋白之一。它通过其N端的PDZ(PSD-95/Dlg/ZO-1)结构域与其他蛋白相互作用,形成复杂的蛋白质网络,进而调控突触的可塑性和神经传递的效率。
PSD的动态特性对突触活动至关重要。PSD内的蛋白质可以经历快速的组装和去组装过程,这种动态变化对于突触适应和学习记忆过程至关重要。PSD-95作为PSD的核心支架蛋白,不仅参与PSD的组装和维持,还通过与多种信号分子的相互作用,调控突触后受体的功能和定位。
Tau蛋白与PSD-95的相互作用
Tau蛋白是一种微管相关蛋白,主要在神经元中表达,参与神经元的骨架维持和物质运输。然而,在阿尔茨海默病患者中,Tau蛋白会发生异常聚集和磷酸化,形成神经纤维缠结,这是AD的主要病理特征之一。近年来的研究表明,Tau蛋白不仅存在于神经元的胞体和轴突中,还定位于突触后区,并与PSD-95发生相互作用。
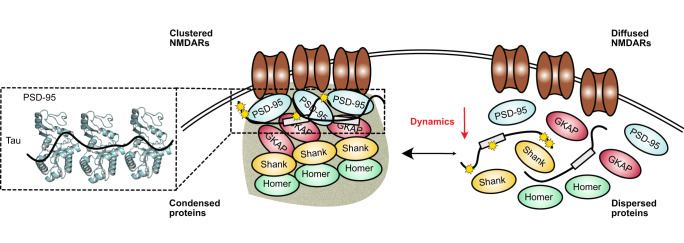
在《Nature Communications》的研究论文中,作者们通过体外实验发现,Tau蛋白能够影响PSD-95及其相关蛋白(如GKAP、Shank、Homer)形成的相分离凝聚物(phase-separated condensates/clusters)的动态特性。这种相分离凝聚物模拟了PSD的液-液相分离过程,是突触后区蛋白质组装和动态调控的重要机制。研究发现,Tau蛋白通过多价相互作用与PSD-95的鸟苷酸激酶(Guanylate Kinase,GK)结构域中的GMP结合口袋结合,导致PSD凝聚物的动态特性发生改变。
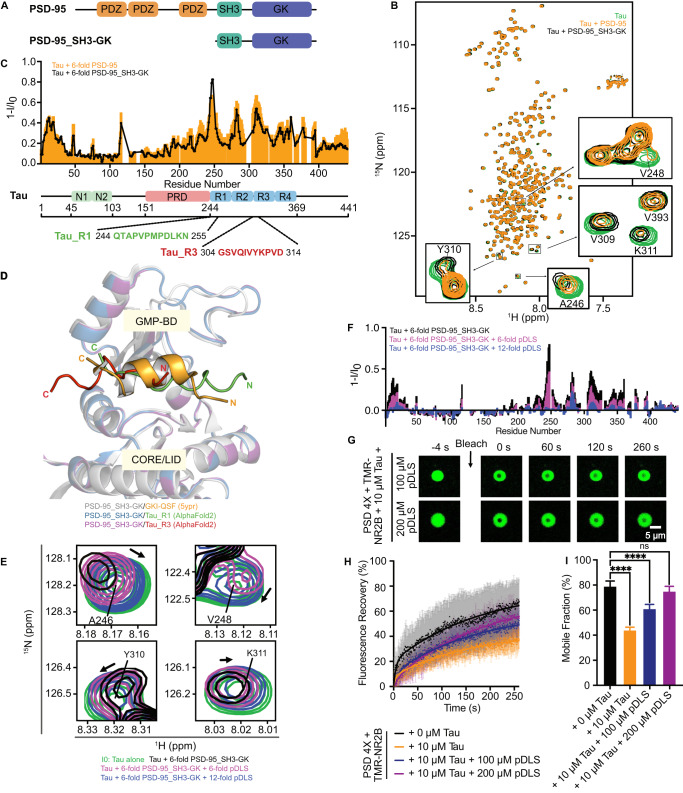
具体而言,Tau蛋白的加入降低了PSD-95在凝聚物中的移动性,减缓了PSD-95的荧光漂白恢复速度(Fluorescence Recovery After Photobleaching,FRAP)。这种动态特性的改变进一步影响了与PSD-95结合的NMDA受体(N-甲基-D-天冬氨酸受体)的动态性,导致NMDA受体在突触后膜上持续聚集和保持活性。这种持续的受体激活可能引发兴奋毒性(excitotoxicity),进而导致神经元的损伤和死亡。
Tau蛋白介导的PSD动态调控与阿尔茨海默病的关系
阿尔茨海默病患者的认知功能损害,特别是在疾病早期阶段,是由突触功能障碍引起的。突触功能障碍和神经网络活动紊乱与NMDA受体的过度活化密切相关。研究表明,AD中NMDA受体的过度活化与Tau蛋白在突触后的聚集有关。Tau蛋白在突触后的定位受磷酸化的调控,磷酸化的Tau蛋白更容易被招募到PSD中,与PSD-95发生相互作用。
在AD患者的脑组织中,磷酸化的Tau蛋白和PSD-95在突触后区的共定位显著增加。这种共定位可能导致PSD的动态特性发生改变,进而影响NMDA受体的功能和定位。如前所述,Tau蛋白介导的PSD动态调控改变可能导致NMDA受体在突触后膜上持续聚集和保持活性,进而引发兴奋毒性和神经元损伤。
此外,研究还发现,与PSD-95高亲和力结合的磷酸化肽能够逆转Tau介导的体外相分离凝聚物的动力学变化。这一发现为靶向PSD的阿尔茨海默病治疗提供了重要的思路。通过调节PSD-95与Tau蛋白的相互作用,可能能够恢复PSD的动态特性,进而改善突触功能和神经网络活动,减缓AD的进展。
PSD-95在神经退行性疾病中的其他作用
除了与Tau蛋白的相互作用外,PSD-95在神经退行性疾病中还扮演着其他重要角色。例如,PSD-95的异常表达或突变可能导致神经元连接的破坏和突触功能的紊乱。在亨廷顿氏病(Huntington's Disease)中,PSD-95的表达水平发生变化,可能与疾病的进展密切相关。此外,PSD-95还与其他神经退行性疾病相关的蛋白(如FMRP、FXR1蛋白等)发生相互作用,共同调控神经元的功能和生存。
研究展望
未来的研究将进一步深入探索PSD-95在神经突触后区的动态调控机制及其在神经退行性疾病中的作用。通过高通量测序、蛋白质组学和结构生物学等技术手段,可以揭示PSD-95与其他蛋白的相互作用网络及其调控机制。此外,利用动物模型和临床样本,可以进一步验证PSD-95在神经退行性疾病中的功能和作用机制,为疾病的诊断和治疗提供新的靶点和策略。
同时,针对PSD-95的干预策略也将成为神经退行性疾病治疗的重要方向之一。通过调节PSD-95的表达、磷酸化状态或其与其他蛋白的相互作用,可能能够恢复PSD的动态特性,改善突触功能和神经网络活动,从而减缓疾病的进展和改善患者的临床症状。
结论
PSD-95作为神经突触后区的核心支架蛋白,在维持突触结构和功能、调控神经传递和突触可塑性方面发挥着重要作用。Tau蛋白与PSD-95的相互作用及其介导的PSD动态调控改变可能是阿尔茨海默病等神经退行性疾病发生发展的重要机制之一。未来的研究将进一步揭示PSD-95的调控机制和功能作用,为神经退行性疾病的诊断和治疗提供新的靶点和策略。
通过对PSD-95的深入研究,我们不仅可以更好地理解神经元的突触功能和神经网络活动,还可以为神经退行性疾病的治疗提供新的思路和方法。随着科学技术的不断进步和研究的深入,相信未来我们能够找到更加有效的治疗手段,帮助患者减缓疾病的进展,提高他们的生活质量。
| 名称 | 货号 | 规格 |
| PSD95 Antibody | 2507S | 100ul |
| PSD95 (D74D3) XP ® Rabbit mAb | 3409T | 20ul |
| PSD95 (7E3) Mouse mAb | 36233T | 20μl |
| Phospho-PSD95 (Ser295) (A8F8Z) Rabbit mAb | 45737T | 20μl |



































