上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|细胞营养代谢调控免疫细胞外囊泡产生及生物活性的重要作用——四川大学刘敬平团队最新研究成果
250 人阅读发布时间:2025-05-14 13:31
引言
细胞外囊泡(Extracellular vesicles, EVs)作为细胞间信息传递的重要载体,近年来在生物医学领域受到了广泛关注。EVs携带了丰富的生物活性分子,如蛋白质、核酸和脂质等,能够参与多种生理和病理过程。基于EVs的免疫疗法已在感染、炎症和肿瘤等疾病的治疗中显示出广阔的应用前景。然而,当前基于细胞培养产生EVs的方法面临着产量较低、EV生物活性不足等瓶颈问题,这严重阻碍了EV免疫疗法的临床转化进程。因此,探索调控免疫细胞中EV产生和活性的新机制,开发提高EV产量及其生物活性的新策略,具有重要的科学意义和临床价值。
近日,四川大学华西医院刘敬平研究员团队在国际权威期刊Science Advances上发表了一项题为“Nutrient availability regulates the secretion and function of immune cell-derived extracellular vesicles through metabolic rewiring”的研究,首次揭示了通过调控细胞营养代谢同时提高EV产量和活性的新策略。该研究成果不仅为理解EV产生和功能的调控机制提供了新的视角,也为开发更高效、精准的治疗性EVs提供了新的策略。

研究背景
营养物质对于维持细胞的正常生长及多种生理过程至关重要。大量研究表明,免疫细胞的表型和功能受营养物质如葡萄糖、氨基酸和脂质等利用率及能量代谢状态的调节。作为细胞分泌的天然纳米囊泡,EVs的产量及生物活性与其供体细胞的代谢状态密切相关。然而,关于如何通过调控细胞营养代谢来影响EV产生和功能的机制,目前尚不清楚。
研究目的
本研究旨在探索通过调控免疫细胞(巨噬细胞,Mφs)的营养代谢状态,来提高其来源的EVs(Mφ-EVs)的产量和生物活性,并揭示其潜在的分子机制。
研究方法
-
细胞培养与EV收集:研究者首先通过调整巨噬细胞培养条件中的营养组分,包括葡萄糖、氨基酸和脂肪酸等,来观察这些营养物质对Mφ-EVs产量的影响。
-
多组学分析:利用高通量测序、蛋白质组学和代谢组学等技术,对Mφ-EVs中的生物分子进行综合分析,以揭示其功能和活性变化的分子基础。
-
功能学实验:通过体外和体内实验,验证Mφ-EVs的免疫激活潜能,如逆转免疫抑制型M2极化、激活单核细胞的趋化和促进T细胞活化等。
-
代谢重塑研究:通过代谢谱分析和基因表达谱分析,揭示GLN剥夺对M1-Mφ代谢状态的影响,以及这种代谢重塑如何影响EV的产生和功能。
-
回补实验:在GLN剥夺条件下,使用α-酮戊二酸(α-KG)和还原型谷胱甘肽(GSH)前体(NAC)进行回补实验,以验证GLN代谢在调控EV产量和功能中的作用。
研究结果
-
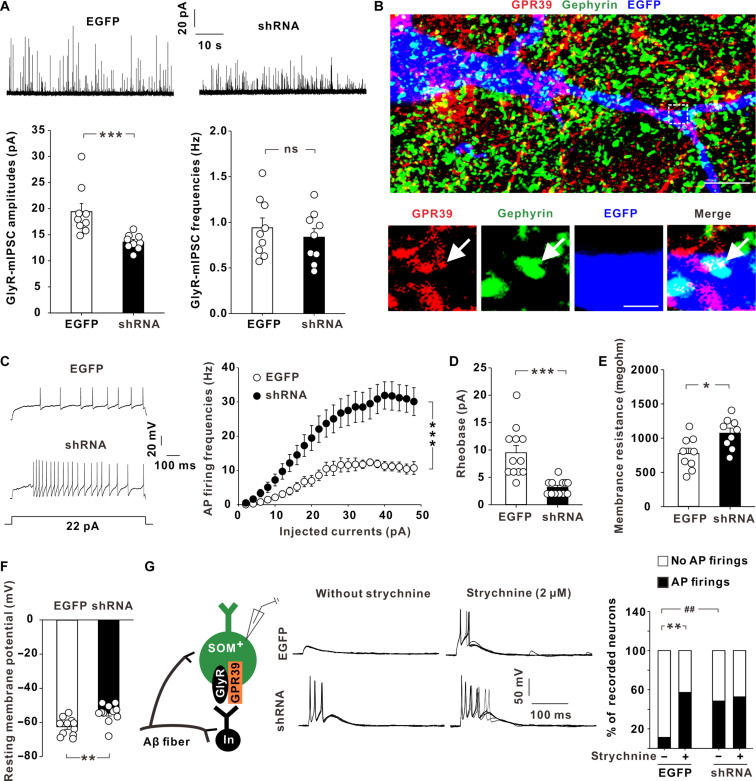
GLN剥夺增加Mφ-EVs产量:相较于常规添加GLN来源的EV(EVGLN+),GLN剥夺或阻断GLN代谢条件下Mφ-EV(EVGLN-)的产量显著增加(~4倍)。
-
EVGLN-富含免疫激活相关分子:多组学分析发现,M1-Mφ来源的EVGLN-富含多种分子(如蛋白和mRNA等),主要富集于免疫激活相关通路。
-
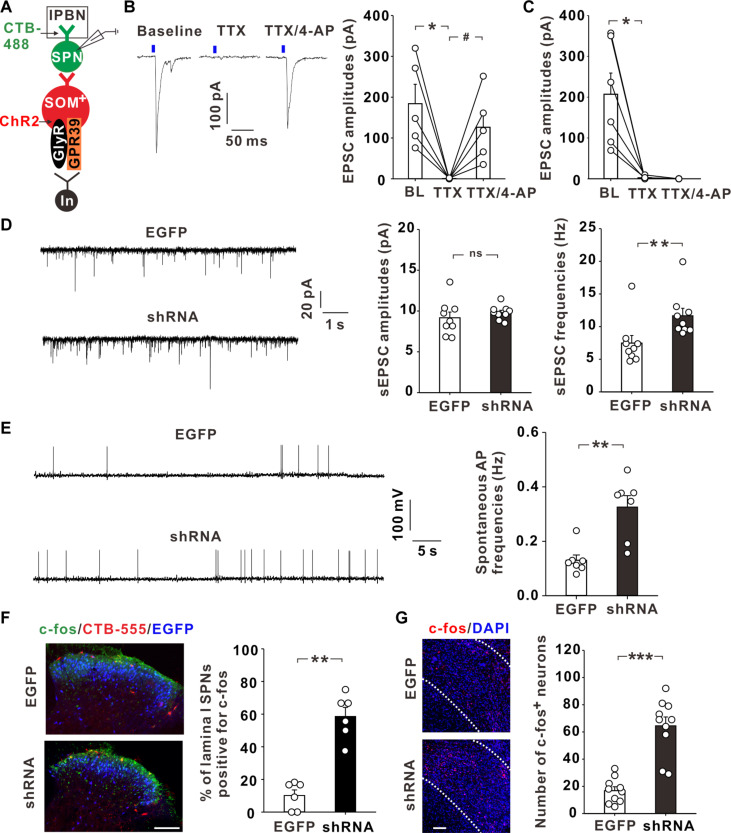
EVGLN-具有更强的免疫激活潜能:功能学实验结果显示,EVGLN-相较于EVGLN+具有更强的免疫激活潜能,如逆转免疫抑制型M2极化、激活单核细胞的趋化和促进T细胞活化等。
-
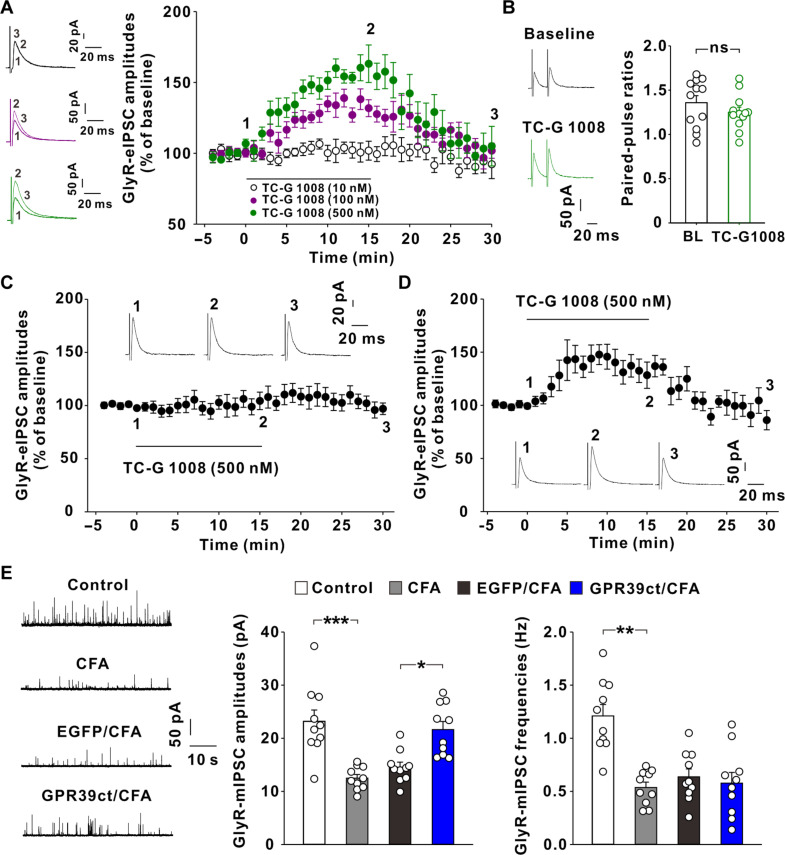
GLN剥夺引发系统性代谢重塑:进一步研究发现,GLN剥夺显著改变了M1-Mφ的基因表达谱和代谢谱,诱导细胞系统性代谢重塑。表现为三羧酸(TCA)循环代谢降低,氧化还原代谢失衡,糖代谢和核苷酸代谢增强等。
-
代谢重编程是EV产量和免疫激活同时增高的原因:作为代谢底物,GLN既可通过α-KG途径进入TCA循环影响能量代谢,也可通过GSH途径维持细胞氧化还原平衡。回补实验结果表明,回补GLN代谢可有效抑制由GLN剥夺所致的M1-Mφ的EV产量和免疫激活因子表达升高。因此,GLN剥夺引发的系统性代谢重编程是导致M1-Mφ中EV产量和免疫激活作用同时增高的潜在原因。
研究意义
-
揭示新的EV调控机制:本研究首次揭示了通过调控细胞营养代谢来影响EV产生和功能的机制,为理解EV的生物学特性提供了新的视角。
-
提供新的治疗策略:通过调控营养物代谢,可以实现高效产生具有特定免疫活性的治疗性EVs。这一策略为开发更高效、精准的治疗性EVs提供了新的思路。
-
推动EV免疫疗法的发展:本研究成果有望为基于EVs的免疫疗法提供新的理论基础和实验依据,推动其在临床上的应用和发展。
研究展望
尽管本研究已经揭示了通过调控细胞营养代谢来提高EV产量和生物活性的新策略,但仍有许多问题需要进一步探讨。例如,除了GLN外,其他营养物质如葡萄糖、脂肪酸等是否也能通过类似机制影响EV的产生和功能?此外,如何将这些发现转化为临床应用,以及如何评估和优化治疗性EVs的安全性和有效性,也是未来研究的重要方向。
结论
本研究通过调控免疫细胞的营养代谢状态,成功提高了其来源的EVs的产量和生物活性,并揭示了其潜在的分子机制。这一研究成果不仅为理解EV产生和功能的调控机制提供了新的视角,也为开发更高效、精准的治疗性EVs提供了新的策略。未来,随着研究的深入和技术的不断进步,基于EVs的免疫疗法有望在多种疾病的治疗中发挥更大的作用。
| 名称 | 货号 | 规格 |
| Goat anti-Rabbit IgG-FITC Antibody | abs20139-100ul | 100ul |
| Goat anti-Rabbit IgG-FITC Antibody | abs20139-500ul | 500ul |
| PE Rat Anti-Mouse F4/80(T45-2342) | 565410 | 100ug |
| APC-Cy7 Rat Anti-Mouse CD45(30-F11) | 561037 | 25ug |