上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|胰腺癌治疗新突破:PELI1介导的RPS3调控机制解析
117 人阅读发布时间:2025-05-23 13:38
引言
胰腺癌作为一种高度恶性的胃肠道肿瘤,以其早期诊断困难、早期转移、治疗反应有限及预后不良等特点,长期以来一直是医学界研究的重点和难点。根据贵州医科大学研究团队在《Journal of Experimental & Clinical Cancer Research》上发表的最新研究论文“PELI1: Key Players in the Oncogenic Characteristics of Pancreatic Cancer”,PELI1介导的RPS3调控机制被揭示,为胰腺癌的治疗提供了新的潜在靶点。

研究背景
胰腺癌在胃肠道系统中是一种常见的恶性肿瘤,其发病率逐年增加,在人类癌症死亡率中的排名从第七位上升到第三位。胰腺导管腺癌(PDAC)占所有胰腺恶性肿瘤的90%以上,是胰腺癌中最主要的类型。尽管根治性切除联合围手术期系统治疗是目前治愈可切除和临界可切除胰腺癌最有效和最独特的方法,但由于缺乏典型的临床症状和有效的筛查工具,大约80%-85%的患者在诊断时已经失去了根治性手术治疗的机会。此外,胰腺癌具有高侵袭性、早期转移和易受治疗耐药的生物学特征,导致即使经过手术切除病灶或联合药物治疗,大多数患者仍面临复发风险。
因此,阐明有助于胰腺癌发展的基本分子机制和通讯途径,成为当前癌症研究的重点。这一研究旨在为及时发现和治疗胰腺癌提供理论基础和实践见解。PELI1作为E3泛素连接酶Pellino家族的成员,在各种生物过程中起着重要作用,包括诱导坏死细胞凋亡、刺激T细胞、介导炎症反应和参与免疫疾病等。已有研究表明,异常的PELI1表达与实体瘤的发展密切相关,与EGFR协同促进乳腺癌转移、甲状腺癌进展,还可增强食管癌放疗敏感性。然而,PELI1在胰腺癌中的作用机制尚未明确,揭示其潜在机制可能有助于胰腺癌的治疗。
研究方法
贵州医科大学研究团队在本研究中采用了多种实验方法,以探究PELI1在胰腺癌中的调控机制。研究团队首先通过组织样本分析和细胞实验,检测了PELI1在胰腺癌组织和细胞中的表达情况。接着,通过一系列分子生物学实验,包括基因敲除、蛋白质相互作用分析、信号通路检测等,深入研究了PELI1如何影响胰腺癌细胞的增殖和转移。
-
组织样本分析:研究团队收集了胰腺癌患者肿瘤组织和正常胰腺组织的样本,利用免疫组化等方法检测了PELI1在两种组织中的表达水平。
-
细胞实验:采用胰腺癌细胞系,通过体外培养实验,观察了PELI1表达对胰腺癌细胞增殖、迁移和侵袭能力的影响。
-
基因敲除实验:利用基因编辑技术,构建了PELI1敲除的胰腺癌细胞系,通过对比野生型和敲除型细胞的生物学行为,进一步验证了PELI1在胰腺癌中的作用。
-
蛋白质相互作用分析:通过免疫共沉淀、质谱分析等方法,鉴定了PELI1与RPS3的相互作用,并探讨了其相互作用机制。
-
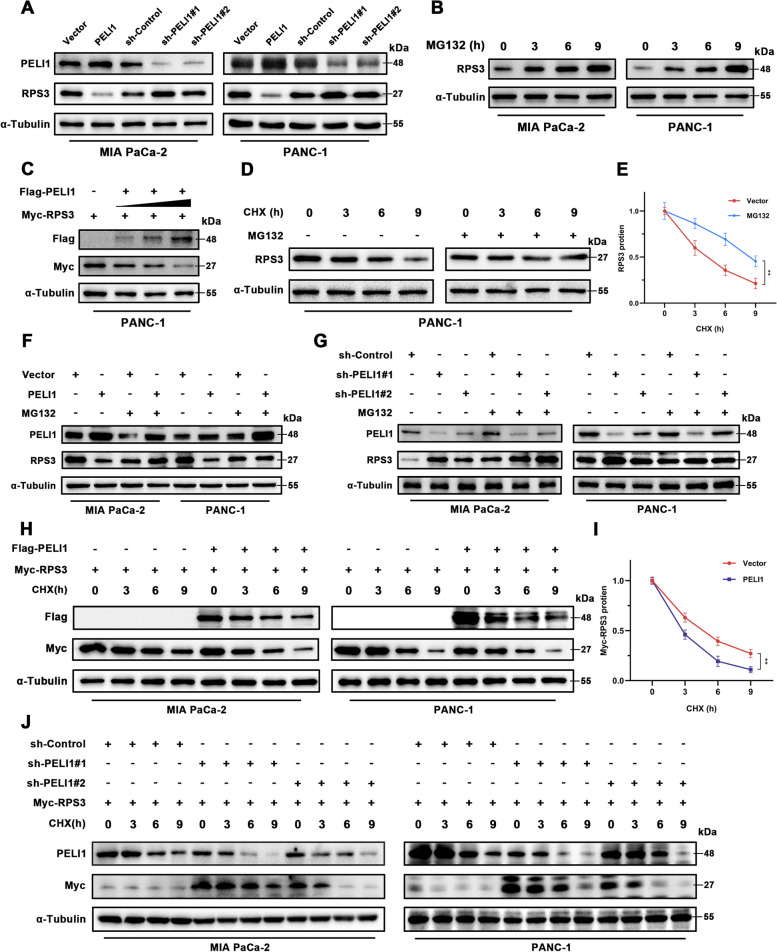
信号通路检测:利用Western blot、荧光素酶报告基因实验等技术,检测了PELI1-RPS3相互作用对PI3K/Akt/GSK3β信号通路及p53泛素化和降解的影响。
研究发现
研究团队通过一系列实验,得出了以下重要发现:
-
PELI1在胰腺癌中高表达:组织样本分析结果显示,PELI1在胰腺癌组织中的表达水平显著高于正常胰腺组织。同时,细胞实验也证实,PELI1在胰腺癌细胞系中高表达,并与患者的预后不良相关。
-
PELI1促进胰腺癌细胞的恶性生物学行为:体外实验表明,PELI1在体内和体外均能显著促进胰腺癌细胞的增殖、迁移和侵袭能力。敲除PELI1后,胰腺癌细胞的恶性生物学行为受到明显抑制。
-
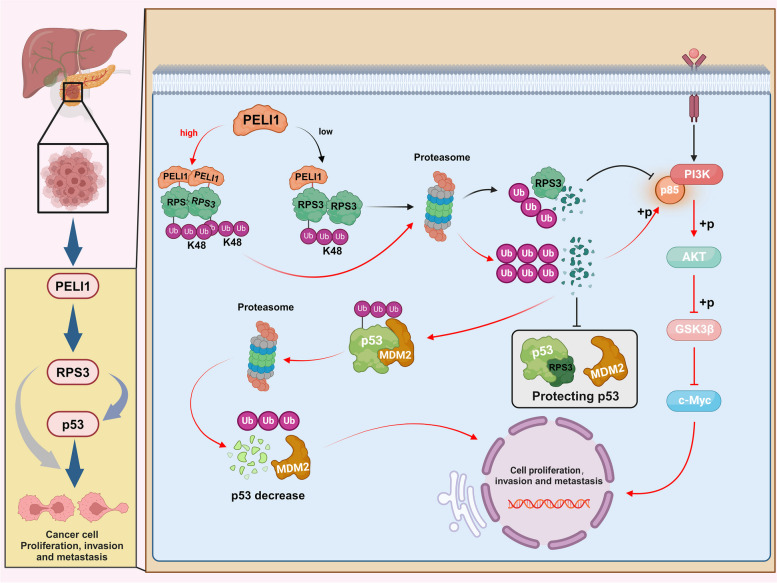
PELI1与RPS3相互作用:通过蛋白质相互作用分析,研究团队发现PELI1通过FHA结构域与RPS3相互作用,并通过K48链上的多泛素化促进RPS3降解。这种相互作用不仅激活了PI3K/Akt/GSK3β信号通路,还促进了MDM2对p53的泛素化和降解。
-
PI3K/Akt/GSK3β信号通路和p53泛素化在胰腺癌中的作用:研究结果显示,PELI1-RPS3相互作用激活的PI3K/Akt/GSK3β信号通路和p53泛素化降解,共同促进了胰腺癌细胞的增殖和转移。抑制PI3K/Akt/GSK3β信号通路或恢复p53功能,均能有效抑制胰腺癌细胞的恶性生物学行为。
临床意义
本研究揭示了PELI1介导的RPS3在胰腺癌中的调控机制,为胰腺癌的治疗提供了新的潜在靶点。以下是该研究成果的临床意义:
-
新的治疗策略:基于PELI1-RPS3相互作用的调控机制,可以开发针对PELI1或RPS3的靶向药物,通过抑制PELI1的表达或阻断其与RPS3的相互作用,抑制胰腺癌细胞的增殖和转移。这种新的治疗策略有望为胰腺癌患者提供更好的治疗效果。
-
预后评估:PELI1在胰腺癌中的高表达与患者预后不良相关,因此,PELI1的表达水平可以作为胰腺癌预后评估的一个重要指标。通过检测PELI1的表达水平,医生可以更准确地判断患者的预后情况,为患者制定更合理的治疗方案。
-
个体化治疗:随着对PELI1-RPS3调控机制的深入研究,未来有望实现针对胰腺癌患者的个体化治疗。根据患者的具体情况,如PELI1的表达水平、基因突变情况等,制定个性化的治疗方案,提高治疗效果和患者的生存率。
未来研究方向
尽管本研究在揭示PELI1介导的RPS3在胰腺癌中的调控机制方面取得了重要进展,但仍有许多问题有待进一步探讨:
-
PELI1在其他类型肿瘤中的作用:PELI1作为一种重要的E3泛素连接酶,在多种实体瘤中均表现出促癌作用。未来可以进一步探讨PELI1在其他类型肿瘤中的调控机制及其潜在靶点价值。
-
RPS3的功能和调控机制:RPS3作为一种核糖体蛋白,在细胞生长和增殖中起着重要作用。本研究发现PELI1通过促进RPS3降解来影响胰腺癌细胞的生物学行为,但RPS3的具体功能和调控机制仍有待深入研究。
-
PI3K/Akt/GSK3β信号通路的其他调控因素:PI3K/Akt/GSK3β信号通路在多种肿瘤中均发挥重要作用,且存在多种调控因素。未来可以进一步探讨其他调控因素如何影响PI3K/Akt/GSK3β信号通路在胰腺癌中的活性及其与PELI1-RPS3相互作用的关系。
-
临床应用的进一步验证:本研究为胰腺癌的治疗提供了新的潜在靶点,但临床应用前还需要进行大量的验证工作。未来可以通过临床试验等方式,进一步验证PELI1或RPS3靶向药物的安全性和有效性。
结论
本研究揭示了PELI1介导的RPS3在胰腺癌中的调控机制,为胰腺癌的治疗提供了新的潜在靶点。通过抑制PELI1的表达或阻断其与RPS3的相互作用,可以显著抑制胰腺癌细胞的增殖和转移,为胰腺癌患者提供更好的治疗效果。未来,随着对PELI1-RPS3调控机制的深入研究及临床应用的进一步验证,有望为胰腺癌的治疗带来新的突破。同时,本研究也为其他类型肿瘤的研究和治疗提供了新的思路和方向。
| 名称 | 货号 | 规格 |
| CDK7 (MO1) Mouse mAb | 2916S | 100ul |
| CDK7 (MO1) Mouse mAb | 2916T | 20ul |



































