上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|CircPAK1在肝细胞癌中的作用及其对乐伐替尼耐药机制的研究
123 人阅读发布时间:2025-05-26 14:27
在恶性肿瘤中,肝细胞癌(HCC)以其高发病率和死亡率著称,给公共卫生带来了巨大挑战。尽管治疗手段不断进步,但HCC的预后依然不容乐观,特别是对于产生耐药性的患者。近期,南京医科大学的研究团队在《Journal of Experimental & Clinical Cancer Research》上发表了一项突破性研究,揭示了CircPAK1在肝细胞癌乐伐替尼耐药机制中的核心作用,为开发新的治疗策略提供了理论基础。

一、研究背景与意义
肝细胞癌(HCC)是全球范围内最常见的恶性肿瘤之一,其发病率和死亡率均居高不下。随着对HCC研究的深入,多种治疗手段被开发出来,但总体而言,HCC患者的预后仍然较差。其中,药物耐药性是制约治疗效果的关键因素之一。乐伐替尼作为一种多激酶抑制剂,已被广泛用于多种肿瘤的治疗,包括肝细胞癌。然而,乐伐替尼耐药性的出现严重限制了其疗效。因此,深入研究乐伐替尼耐药机制,寻找新的治疗靶点,对于提高肝细胞癌患者的治疗效果和预后具有重要意义。
环状RNA(circRNA)是近年来发现的一类新型非编码RNA,在肿瘤的发生、发展和耐药机制中发挥着重要作用。越来越多的研究表明,circRNA与多种肿瘤的发病机制密切相关,并有望成为新的治疗靶点。南京医科大学的研究团队通过对肝细胞癌组织和细胞系的研究,发现了一种新的circRNA——CircPAK1,并揭示了其在乐伐替尼耐药机制中的关键作用。这一发现不仅深化了我们对circRNA在肿瘤耐药机制中的认识,也为开发新的治疗策略提供了理论依据。
二、CircPAK1的发现与鉴定
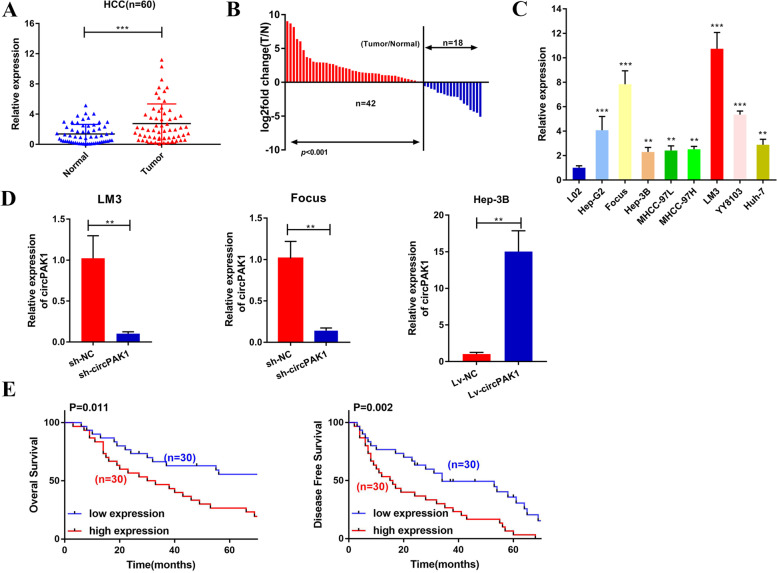
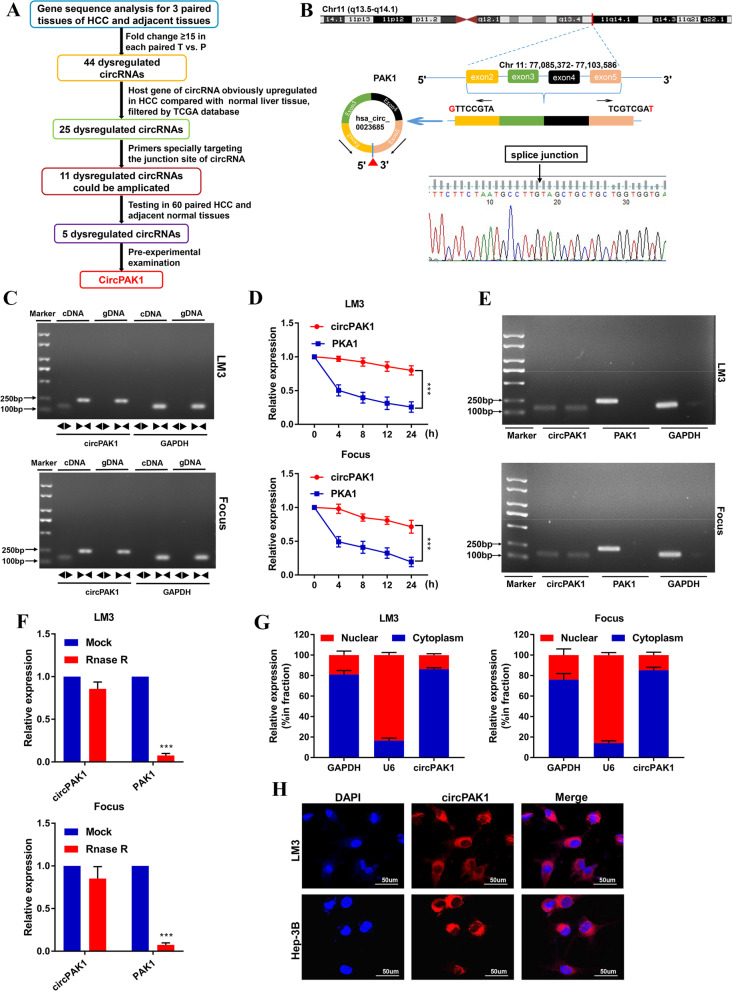
研究团队首先对肝细胞癌组织和邻近正常组织进行了高通量测序,旨在鉴定参与肝细胞癌进展的circRNA。在351个差异表达的circRNA中,筛选出了211个在肝细胞癌组织中上调的circRNA。通过进一步验证,最终确定了CircPAK1作为研究对象。CircPAK1来源于11号染色体,由PAK1基因中的4个相邻外显子组成,并通过sanger测序证实了其连接位点。
为了进一步验证CircPAK1的环状结构,研究团队采用了琼脂糖凝胶电泳、RNase R消化和放线菌素D RNA稳定性测定等方法。结果显示,与线性PAK1相比,CircPAK1具有更高的生物稳定性。此外,FISH和qRT-PCR结果表明,CircPAK1主要定位于细胞质中。这些发现为后续研究CircPAK1在肝细胞癌中的功能奠定了基础。
三、CircPAK1在肝细胞癌中的功能与机制
1. CircPAK1促进肝细胞癌的增殖、迁移和侵袭
为了探究CircPAK1在肝细胞癌中的功能,研究团队构建了CircPAK1敲低和过表达的细胞系,并进行了CCK-8、EdU、集落形成、伤口愈合和跨孔等实验。结果显示,CircPAK1敲低显著减弱了肝细胞癌细胞的生长、迁移和侵袭能力,而CircPAK1过表达则增强了这些能力。这些结果表明,CircPAK1在肝细胞癌的增殖、迁移和侵袭过程中发挥着重要作用。
2. CircPAK1抑制肝细胞凋亡
进一步的研究发现,CircPAK1不影响肝细胞癌细胞的细胞周期,但敲低CircPAK1后,LM3和Focus细胞的凋亡率显著增加。这表明CircPAK1对肝细胞癌细胞生长的促进作用可能取决于其对凋亡的抑制作用。这一发现为CircPAK1在肝细胞癌中的抗凋亡作用提供了有力证据。
3. CircPAK1促进血管生成
血管生成是肿瘤生长和转移的关键因素之一。研究团队通过血管生成实验发现,CircPAK1敲低显著抑制了人脐静脉内皮细胞(HUVECs)的迁移和侵袭能力,而CircPAK1过表达则增强了这些能力。此外,管形成测定也显示,CircPAK1敲低减少了HUVECs的分支位点数量。这些结果表明,CircPAK1在体外具有诱导肝细胞癌血管生成的能力。
4. CircPAK1促进体内肝细胞癌肿瘤生长和转移
为了评估CircPAK1在体内对肝细胞癌生长和转移的影响,研究团队构建了肿瘤异种移植和肺转移模型。结果显示,无论是肿瘤大小还是肿瘤重量,CircPAK1敲低组均显著降低,而CircPAK1过表达组则增加。此外,肺转移模型也表现出相似的趋势。这些结果表明,CircPAK1在体内也具有促进肝细胞癌肿瘤生长和转移的能力。
四、CircPAK1在乐伐替尼耐药机制中的作用
1. CircPAK1在乐伐替尼耐药细胞系中表达上调
为了验证CircPAK1是否参与介导肝细胞癌乐伐替尼耐药性,研究团队使用了两种乐伐替尼耐药的肝细胞癌细胞系(LM3-LR和Hep-3B-LR)。qRT-PCR分析结果显示,这两种耐药细胞系中的CircPAK1表达水平始终高于其亲本细胞系。这表明CircPAK1可能与肝细胞癌乐伐替尼耐药性密切相关。
2. CircPAK1敲低增加乐伐替尼敏感性
为了探究CircPAK1与乐伐替尼耐药性之间的潜在相关性,研究团队沉默了LM3-LR和Hep-3B-LR细胞中的CircPAK1,并进行了细胞活力测定。结果发现,CircPAK1敲低显著增加了这两种耐药细胞系对乐伐替尼的敏感性。这表明CircPAK1对于维持乐伐替尼耐药至关重要。
3. CircPAK1通过外泌体介导乐伐替尼耐药性转移
研究团队进一步发现,CircRNA在外泌体中含量丰富,并可以通过外泌体在细胞之间转移。为了验证CircPAK1是否可以通过外泌体导致乐伐替尼耐药,他们从LM3-LR和Hep-3B-LR细胞的条件培养基中分离了外泌体,并通过TEM、NTA和WB等方法进行了鉴定。结果显示,从耐药细胞系中分离的外泌体含有更多的CircPAK1。进一步的研究发现,这些外泌体可以将CircPAK1从耐药细胞系转运到其亲本细胞系,并赋予受体细胞耐药表型。这表明CircPAK1可以通过外泌体介导乐伐替尼耐药性在肝细胞癌细胞中的转移。
五、CircPAK1的作用机制:通过与YAP竞争性结合14-3-3ζ介导YAP细胞核定位
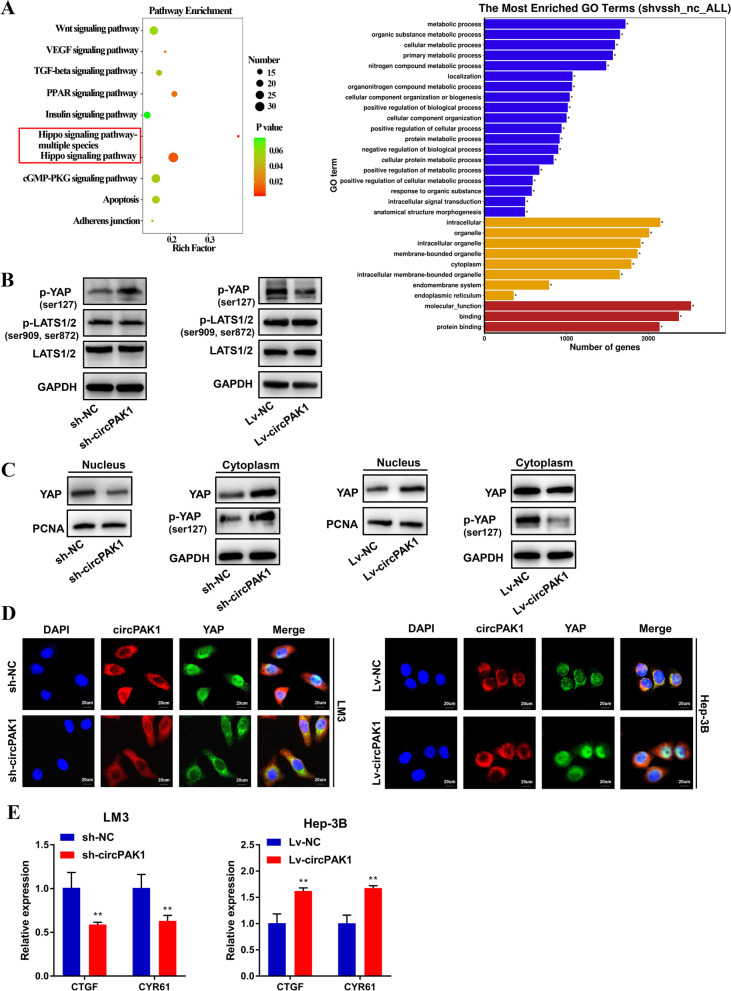
为了探究CircPAK1在肝细胞癌中发挥作用的分子机制,研究团队进行了RNA测序和一系列蛋白质印迹分析。他们发现,CircPAK1并不影响LATS1/2的水平或其磷酸化水平,但可以影响YAP的磷酸化状态和细胞核定位。进一步的研究发现,CircPAK1可以与14-3-3ζ竞争性结合,从而削弱p-LATS和YAP的募集,减少p-LATS对YAP的磷酸化,进而促进YAP的细胞核定位。这一发现揭示了CircPAK1通过关闭Hippo信号通路导致肝细胞癌进展的新机制。
六、结论与展望
综上所述,南京医科大学的研究团队揭示了CircPAK1在肝细胞癌乐伐替尼耐药机制中的关键作用。他们发现,CircPAK1在乐伐替尼耐药的肝细胞癌细胞系中表达上调,并通过与YAP竞争性结合14-3-3ζ介导YAP的细胞核定位,从而关闭Hippo信号通路并促进肝细胞癌的进展。此外,他们还发现CircPAK1可以通过外泌体在肝细胞癌细胞之间传递耐药性。这些发现不仅深化了我们对circRNA在肿瘤耐药机制中的认识,也为开发新的治疗策略提供了理论依据。
展望未来,随着对CircPAK1功能的进一步研究和深入,我们可以期待其在肝细胞癌的治疗中发挥更大的作用。通过开发针对CircPAK1的特异性抑制剂或调控其表达水平,有望为肝细胞癌患者提供新的治疗选择,改善其治疗效果和预后。同时,CircPAK1在外泌体介导的耐药性传递中的作用也为我们提供了新的研究方向和思路。通过探究外泌体在肿瘤耐药机制中的具体作用机制,我们可以为开发针对外泌体的新型治疗策略提供理论依据和实践指导。