上海优宁维生物科技股份有限公司代理商
19 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
技术资料/正文
文献解析|氧化应激通过Thbs1介导的M1样肿瘤相关巨噬细胞极化促进口腔癌变
374 人阅读发布时间:2025-07-03 13:10
一、引言与研究背景
在肿瘤学领域,氧化应激作为一种重要的生物学过程,与肿瘤的发生、发展和转移密切相关。尤其在口腔癌中,氧化应激的作用机制尚未完全阐明,但其对口腔癌初始阶段的潜在影响备受关注。近期,一篇题为《Oxidative stress promotes oral carcinogenesis via Thbs1-mediated M1-like tumor-associated macrophages polarization》的研究文章,为理解氧化应激在口腔癌变过程中的具体作用提供了新的视角。
该研究聚焦于丙氨酸-丝氨酸-半胱氨酸转运体2(ASCT2)在口腔癌发生中的作用。ASCT2作为谷氨酰胺转运的关键蛋白,参与谷胱甘肽合成,从而有助于缓解氧化应激。然而,当ASCT2缺失时,其导致的氧化应激状态及其对口腔癌变的影响尚不清楚。因此,本研究旨在揭示ASCT2缺失如何通过诱导氧化应激,进而促进口腔癌变的具体机制。

二、研究方法与实验设计
为了深入探究ASCT2缺失与口腔癌变之间的关系,研究者们采用了转基因小鼠模型,特异性地在口腔上皮细胞中敲除ASCT2基因。随后,利用4-硝基喹啉-1-氧化物(4-NQO)诱导口腔癌变,以观察ASCT2缺失对口腔癌变进程的影响。
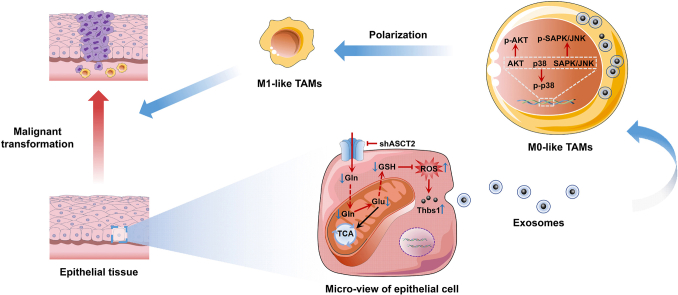
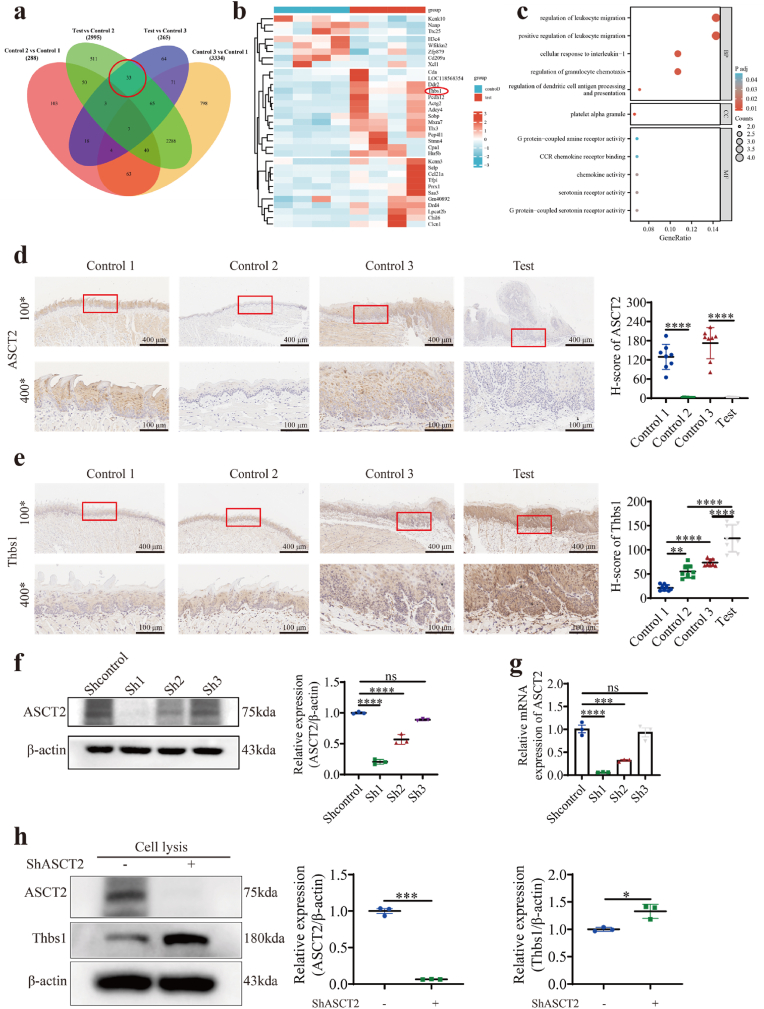
在实验设计上,研究者们首先通过mRNA测序和免疫组织化学方法,鉴定了与巨噬细胞浸润相关的上调基因Thbs1。进一步地,他们利用多重免疫组织化学技术,确认了M1样肿瘤相关巨噬细胞(TAMs)在癌区的富集。为了深入理解ASCT2缺失如何导致M1样TAMs极化,研究者们还探讨了谷氨酰胺摄取、细胞内活性氧(ROS)积累、Thbs1表达以及p38、Akt和SAPK/JNK信号通路的激活之间的相互作用。
三、研究结果与发现
- ASCT2缺失导致氧化应激并促进口腔癌变
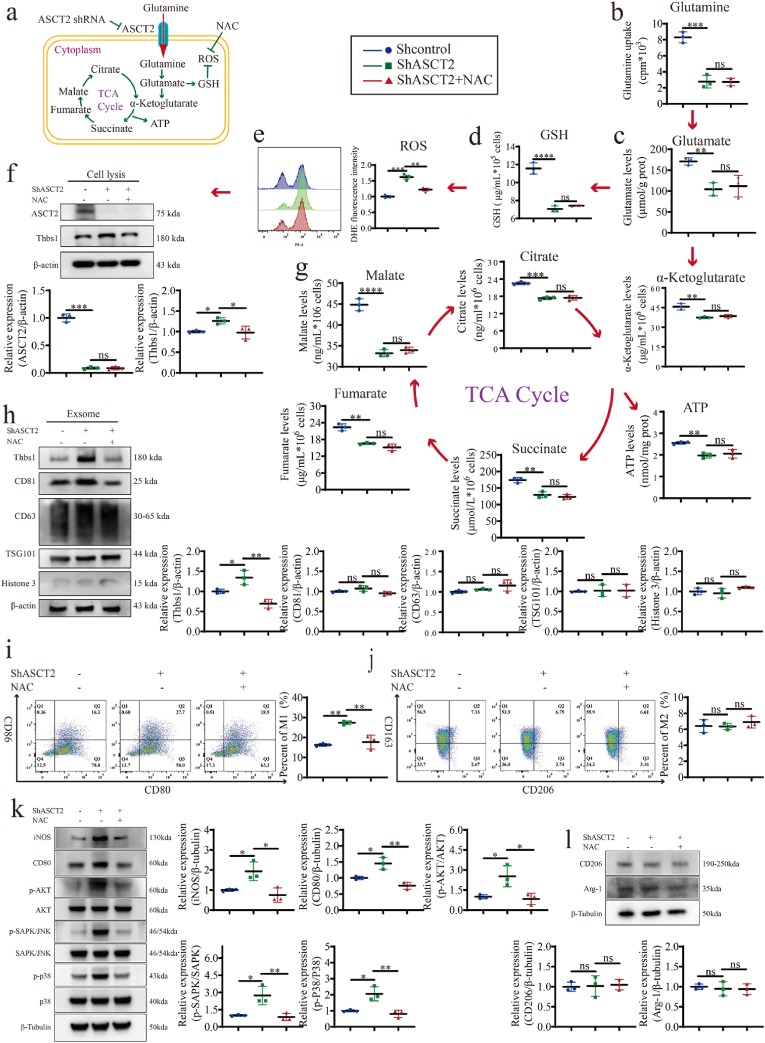
研究结果显示,ASCT2敲除小鼠在4-NQO诱导下,口腔癌变的发生率显著增加。这一发现表明,ASCT2缺失确实促进了口腔癌变的发生。进一步分析显示,ASCT2缺失导致口腔粘膜内谷氨酰胺摄取减少,进而引发细胞内ROS积累,即氧化应激状态。
- Thbs1上调与巨噬细胞浸润
通过mRNA测序和免疫组织化学方法,研究者们鉴定了ASCT2缺失后上调的Thbs1基因。Thbs1作为一种与巨噬细胞浸润相关的分子标记,其上调可能意味着巨噬细胞在口腔癌变过程中的重要作用。多重免疫组织化学技术进一步证实了M1样TAMs在癌区的富集,提示Thbs1可能与M1样TAMs极化有关。
- M1样TAMs极化机制
为了揭示M1样TAMs极化的具体机制,研究者们深入探讨了谷氨酰胺摄取、ROS积累、Thbs1表达以及信号通路激活之间的相互作用。他们发现,ASCT2缺失导致的谷氨酰胺摄取减少和ROS积累,上调了口腔角质形成细胞中的Thbs1表达。随后,Thbs1通过外泌体转移途径,激活了p38、Akt和SAPK/JNK信号通路,从而促进了M1样TAMs的极化。
- M1样TAMs促进口腔癌恶性进展
最后,研究者们利用4-NQO诱导的DOK转化细胞系,在体内外实验中验证了M1样TAMs对口腔鳞状细胞癌(OSCC)恶性进展的促进作用。这一发现进一步强调了M1样TAMs在口腔癌变过程中的关键作用,并提示针对M1样TAMs的干预策略可能具有潜在的治疗价值。
四、讨论与意义
本研究揭示了ASCT2缺失通过诱导氧化应激,进而促进口腔癌变的具体机制。其中,Thbs1上调和M1样TAMs极化作为关键步骤,在口腔癌变过程中发挥了重要作用。这一发现不仅深化了我们对氧化应激在口腔癌变中作用机制的理解,还为预防和治疗口腔潜在恶性病变提供了新的思路。
首先,从基础研究的角度来看,本研究为氧化应激与口腔癌变之间的关系提供了新的证据。通过敲除ASCT2基因并观察其对口腔癌变进程的影响,研究者们成功地揭示了氧化应激在口腔癌变初始阶段的重要作用。这一发现有助于我们更深入地理解口腔癌变的生物学机制,并为未来的研究提供了新的方向。
其次,从临床应用的角度来看,本研究提示恢复氧化还原平衡可能成为预防和治疗口腔潜在恶性病变的新途径。通过抑制ASCT2缺失导致的氧化应激状态,或针对Thbs1和M1样TAMs进行干预,可能有助于减缓口腔癌变的进程,甚至实现早期预防和治疗。这一发现为口腔癌的预防和治疗提供了新的思路和方法。
此外,本研究还强调了肿瘤微环境在口腔癌变过程中的重要性。M1样TAMs作为肿瘤微环境中的重要组成部分,其极化状态对口腔癌变的进程具有显著影响。因此,针对肿瘤微环境的干预策略可能具有潜在的治疗价值,值得进一步研究和探索。
五、结论与展望
综上所述,《Oxidative stress promotes oral carcinogenesis via Thbs1-mediated M1-like tumor-associated macrophages polarization》一文揭示了ASCT2缺失通过诱导氧化应激并促进Thbs1上调和M1样TAMs极化,进而促进口腔癌变的具体机制。这一发现不仅深化了我们对口腔癌变生物学机制的理解,还为预防和治疗口腔潜在恶性病变提供了新的思路和方法。
展望未来,研究者们可以进一步探索ASCT2、Thbs1和M1样TAMs之间的相互作用关系,以及它们在其他类型肿瘤中的作用机制。同时,针对这些分子的干预策略也可能成为未来肿瘤治疗的新方向。此外,深入研究肿瘤微环境在口腔癌变过程中的作用机制,也将为口腔癌的预防和治疗提供更多的启示和可能。



































